NAT MATER丨膜失稳离子化的磷脂用于器官选择性mRNA传递和CRISPR–Cas基因编辑
作者:徐雪梅
介绍一篇最近发表在Nature Materials的文章,通讯作者是德克萨斯大学西南医学中心的Daniel J. Siegwart。该课题组主要研究方向是开发先进的聚合物和基于脂质的系统,精确控制大分子的结构、顺序和反应性,应用于药物输送、成像、遗传疾病和癌症治疗。
内质体逃逸仍然是阻碍核酸治疗进展的一个基本障碍。从构成生物膜的天然磷脂中获得灵感,本文报道的多尾可电离磷脂(iPhos),能够在体内递送mRNA或Cas9 mRNA/guide RNA用于基因编辑。优化后的iPhos脂质体由一个pH可调两性离子头和三个疏水尾组成,在溶酶体酸性环境中呈锥形,有利于膜的六角形相转化和随后的内体内货物释放,iPhos的化学结构可以控制体内药效和器官选择性。iPhos脂质与各种辅助脂质协同作用形成多组分脂质纳米粒(称为iPLNPs),可以用于选择性器官靶向。两性离子、可离子化阳离子和永久性阳离子辅助脂质可使iPLNPs分别在脾、肝和肺中实现组织选择性mRNA递送和CRISPR基因编辑。这种功能性磷脂的设计对基因编辑研究和治疗应用具有重要价值。
磷脂分布于自然界中,是生物膜和细胞器的关键组成部分,参与细胞运输途径。脂质体可以通过插入自然形成的膜来增强内体逃逸,从而克服目前载体的关键限制。但是,即使是最有效的载体,包括FDA批准的DLin-MC3-DMA脂质纳米粒(LNPs),也只能介导1-4%的RNA释放到细胞质中,这意味着内体逃逸仍然是递送过程中最具有挑战性的问题。最常用的磷脂,如DSPC和DOPE具有恒定的一个不可逆两性离子(至少在生物体中)和两个疏水尾,缺乏可操纵的化学手柄。受阳离子脂质设计的启发,本文提出将它们的优势(例如,可离子化胺和多烷基链)整合到磷脂的设计中,将显著改善其功能。首先,中性生理环境和酸性内体之间的可电离可逆两性离子可能导致pH触发的膜破裂;其次,一个小的两性离子头与两个以上的疏水尾体相结合,更容易形成锥状结构,引起强烈的膜相变趋势。开环二氧磷杂环氧化物分子能够与伯胺、仲胺和叔胺共轭,从而通过这种模块化合成策略可以实现可控的疏水尾数和pH值可调的两性离子。
目前为止,大多数载体仅对肝细胞有效,肝外给药是未来遗传病治疗的主要需求。在优化了材料结构后,作者发现合成的iPhos脂质能够建立结构选择性关系,从而进一步确定肝外传递的机制。组织选择性载体的开发对于减少副作用和靶向治疗遗传病所需的细胞类型具有重要意义。本文报道了572种iPhos脂质的合成,其能够通过生物激发机制在体内传递mRNA或Cas9 mRNA/sgRNA用于基因编辑。经过初步测验,含有一个叔胺、一个磷酸基和三个烷基尾的iPhos脂质(7A1P4–13A1P16)能够实现最高的蛋白质表达。pH可切换的小两性离子头和多尾辅助内体膜融合和六边形相变。构效关系表明,iPhos脂类的尾部长度既影响活体mRNA递送的有效性,也影响器官选择性。与以前的基准DOPE和DSPC相比,性能最好的iPhos 9A1P9在活体内的功效提高了40-965倍。且9A1P9具有普适性,可与两性离子、可离子化阳离子和永久性阳离子辅助脂质协同作用,形成用于选择性器官靶向(SORT)的多组分LNP,以介导脾、肝或肺的特异性转染。最佳的9A1P9-5A2-SC8和9A1P9-DDAB分别介导肝脏和肺的高mRNA表达和CRISPR-Cas9基因编辑。
合理设计iPhos以获得最佳核内体逃逸:
在过去的几十年中,大量的研究建立了四组分LNP系统用于RNA的传递,它们由阳离子可电离脂质、磷脂、胆固醇和聚乙二醇(PEG)脂质组成。迄今为止,磷脂种类和结构仅限于,如普通磷脂(DSPC和DOPE)通常具有一个不可逆两性离子和两个疏水性尾部,它们缺乏改变内体形状以满足内体逃逸需求的化学特征。为此,作者设计了iPhos脂质,其中含有一个可电离胺、一个磷酸基团和三个疏水尾。由胺基和磷酸基组成的小两性离子在不同的pH下是可逆的。在生理pH值(约7.4)下,叔胺基不会质子化,带负电的iPhos很难融合到膜中。相反,在进入酸性内体时,叔胺将质子化形成两性离子头(图1a)。通过逐一验证,发现三个疏水尾巴比两条疏水尾巴更容易介导膜的相变。因此,其作用机制不同于传统的基因载体,因为人工合成的iPhos脂质可以整体插入天然磷脂膜中,具有优选的小离子对与采用锥形的大尾体耦合,以促进六角形II(HII)相的形成(图1b)。图1c,1d分别表示iPhos的合成过程及28种胺和13种烷基化二氧磷杂环氧化物原料分子列表。

图1. iPhos脂质的化学合成过程,阐明了iPhos脂质增强内体逃逸的物理作用机制。a, 有效的iPhos脂质由一个可离子化胺、一个磷酸基团和三个疏水性烷基链组成。在进入酸性内体/溶酶体时,叔胺的质子化诱导两性离子头,它可以很容易地插入到膜中。b, 当iPhos脂质被混合并插入到内体膜中时,由小的离子对头和多个疏水尾形成的锥状结构使其发生六角形转变。c, iPhos的合成路线。d, 用于iPhos合成的28种胺和13种烷基化二氧磷杂环氧化物分子列表。
最优化的iPhos拥有一个pH值可切换的头部和三个疏水尾部:
为了评估mRNA递送的能力,iPhos LNPs (iPLNPs)被用于转染卵巢癌细胞IGROV1。用乙醇稀释法将iPhos、辅助脂质、胆固醇和DMG-PEG2000(25:30:30:1 mol/mol)与mRNA混合以形成iPLNPs。如图2a-2c所示,从热图看,单一两性离子(1A1P4–18A1P16)的iPhos比多重两性离子(19A2P4–28A5P16)的mRNA递送效率更高。这是由于多个两性离子形成了一个较大的头部,使膜的相变的发生比较困难。单一两性离子的iPhos的构效关系表明,双尾材料(1A1P4–6A1P16)的效果要差得多,因为小尾体不能与天然膜磷脂形成锥形。而iPhos14A1P4-18A1P16具有永久性两性离子,缺乏内体内化的结构灵活性。由一个叔胺、一个磷酸基团和三个疏水尾组成的iPhos(7A1P4-13A1P16)表现出了最高mRNA递送效率,命中率约为60%(图2d)。较小的两性离子头体和较大的尾体促进了膜的融合和由片层状向六边形的相变。在这些iPhos脂类中,胺尾长度是最重要的,其中10-12链长的命中率高达92%(图2e)。选择top iPhos脂类(9A1P9, 9A1P15,10A1P10和10A1P16)纯化,得到的iPLNPs显示出粒径大致为150纳米,体外细胞递送为内吞作用,稍微负的表面zeta电位(大约−5 mV)用于血清蛋白抗性,以及pKa为6.0-6.5。这些功能赋予了合成iPhos脂类在体内应用的巨大潜力。
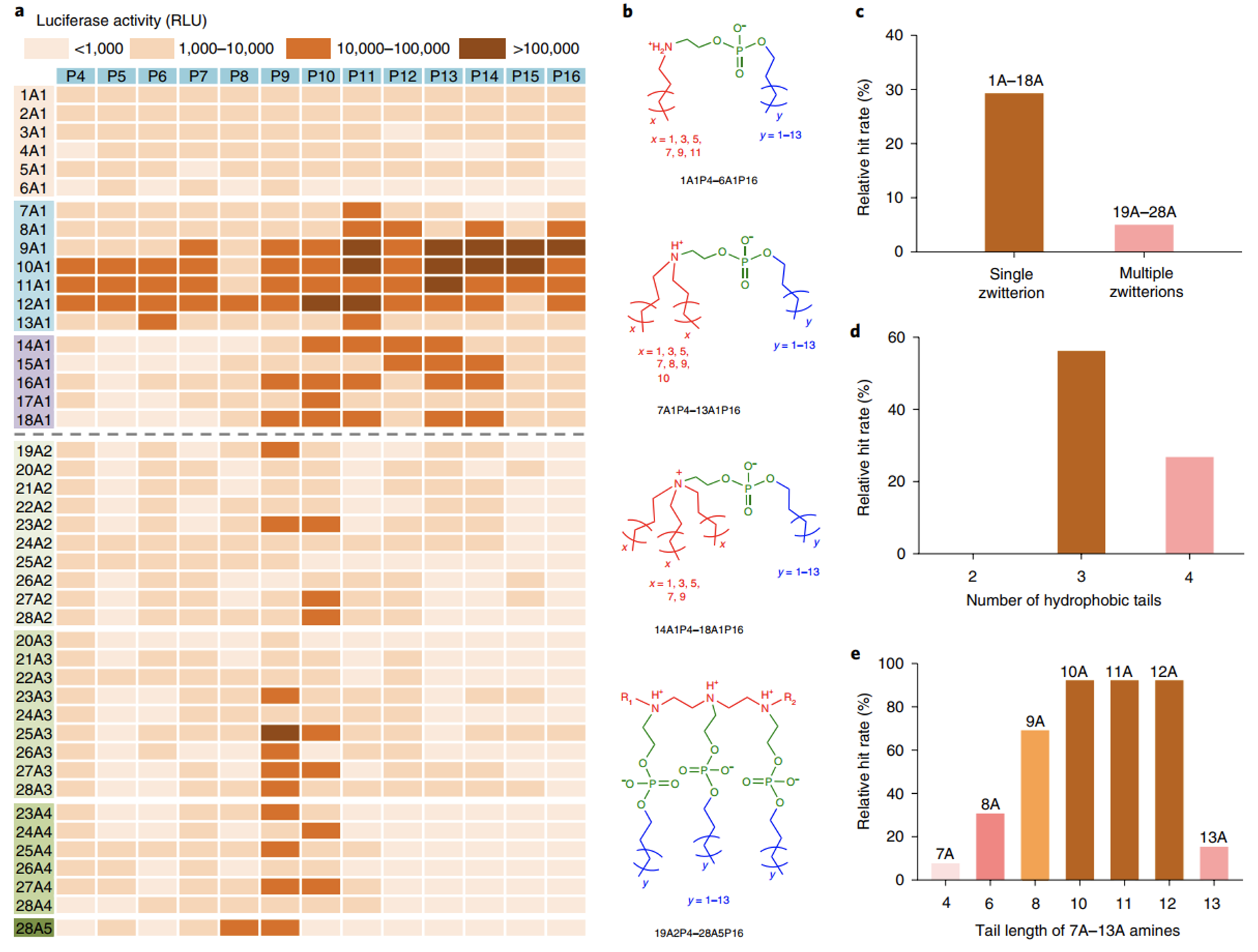
图2. iPhos脂质对荧光素酶mRNA体外传递的SAR研究。a、iPLNPs处理IGROV1细胞后荧光素酶表达的热图。相对光单位(RLU)用于命中率计算。b,酸性内体环境中两性离子数和尾数不同的典型的iPhos的化学结构。c、单两性离子和多两性离子iPhos的相对命中率关系。d、iPhos(1A1P4–18A1P16)的相对命中率与具有单个两性离子和不同尾数的关系。e、在有效的iPhos(7A1P4–13A1P16)中,起始胺的尾长与最终的体外疗效的关系。
模型构建:
为了验证关于mRNA递送的假设,作者使用31P核磁共振波谱技术研究了相转化。模仿脂质体的内体采用了双层结构,这在低场肩处得到了证明。与iPhos脂质混合后,脂质体的峰不对称性被逆转,脂质体转变为六方相(图3a)。接下来,用溶血模型评估iPhos脂质和iPLNPs的膜破坏活性。正如预期,具有pH可切换两性离子的10A1P10比具有简单叔胺的17A表现出更高的溶血率,验证了两性离子在膜融合和破裂方面的优越性(图3b)。此外,与中性pH相比,9A1P9、10A1P10和相关iPLNPs在酸性内体中表现出更高的膜破坏活性(图3c,3d)。利用FRET效应模拟iPhos脂质膜融合和iPLNP分离,如图3e所示,10A1P10 iPLNPs比25A3P9 iPLNPs表现出更高的脂质融合,表明与多个两性离子相比,单个两性离子小头显示出更强的插入和破坏内质体膜的趋势。此外,10A1P10 iPLNPs与内体模拟脂质体混合后,比25A3P9 iPLNPs更容易分解释放mRNA(图3f,3g)。这些结果表明,除了一个大的尾体外,iPhos脂质中pH值可调的小两性离子头对于内体逃逸也是必不可少的。

图3. 内体逃逸的模型膜研究表明,iPhos脂质体介导的RNA传递机制与化学结构相关。a,内体模拟体的谱和内体模拟体与iPhos 9A1P9的混合物的31P NMR谱。iPhos脂质混合诱导膜六边形的转换。b, pH 5.5时17A和10A1P10用于溶血实验对比,两性离子明显有利于内体的逃逸。c, 在不同的pH下9A1P9和10A1P10的溶血效果。d,不同pH下iPLNPs的溶血。e, 采用FRET测定pH值为5.5时10A1P10和iPLNPs的脂质融合和膜破裂。f,在pH 5.5下与内体模拟物混合后,通过FRET表征iPLNP解离。单个两性离子比多个两性离子表现出更高的脂质融合和iPLNP解离效果。g, 10A1P10 iPLNP在pH 5.5下不同时间间隔下的解离效果。
iPhos结构控制的药效和器官选择性:
作者从体外筛选中选择了51种有效的iPhos脂质,并在低mRNA剂量的体内传递进行了评估 (图4a)。正如预期的那样,含有多种离子的iPhos脂质在体内无法递送mRNA。构效关系表明,以含有一个叔胺、一个磷酸基团和三个烷基尾的iPhos脂类最为有效。烷基链长对效率和器官选择性有很大影响。胺侧链的长度决定了功效,8-10个碳长度介导了体内mRNA的高表达(与4b)。磷酸基旁边的烷基长度影响器官的选择性(图4c,4d)。较短的链(9-12个碳)在肝脏中显示mRNA翻译,而较长的链(13-16个碳)的蛋白质在脾脏中更高。作者推测器官选择性与mRNA载体物质的化学结构有关,但详细的机理研究仍在进行中。

图4. 构效关系表明,iPhos脂质结构可控制体内有效性和器官选择性。a,在低Fluc mRNA剂量(0.1 mg kg−1)下对51个iPhos进行体内评估。注射iPLNPs至C57BL/6小鼠后6 h,记录各脏器的生物发光图像。b,在有效的10A1P4-12A1P16 iPhos中,胺侧疏水链的长度显著影响体内mRNA递送效果。c,磷酸基侧不同烷基链长度的iPhos对肝脏mRNA表达的影响。d,磷酸基侧不同烷基链长度的iPhos在脾脏中的mRNA表达。
iPLNPs介导的组织选择性基因传递和编辑:
为了证实iPhos 9A1P9是iPLNPs中最重要和最活跃的成分,作者进行了一系列的实验。
首先,9A1P9的体内有效性比目前使用的最好的磷脂制剂和磷脂高出40- 965倍(图5a-5c)。接下来研究了iPhos是否可以用于选择性器官靶向。结果表明,带有两性离子、可电离阳离子和永久阳离子辅助脂质的9A1P9 iPLNPs分别在脾、肝和肺中实现选择性mRNA表达(图5d-5i)。体内生物分布结果显示球形9A1P9-5A2-SC8和9A1P9-DDAB iPLNPs分别介导肝脏和肺的高聚集。由于iPhos脂质可以以一种模块化的方式增强已经有效的配方,确定9A1P9-5A2-SC8和9A1P9-DDAB组合分别在肝脏和肺中表现出高mRNA表达(图5f-5i)。与已建立的配方相比,9A1P9- 5A2-SC8 iPLNPs的mRNA传递效果比DLin-MC3-DMA LNPs高13倍(图5j-5k)。为了验证iPLNPs诱导器官选择性基因编辑的能力,我们使用了一个可激活的Cre-LoxP小鼠模型 Lox-stop-Lox tdTomato在所有组织中。通过iPLNP递送Cre-重组酶mRNA (Cre mRNA),翻译后的Cre蛋白只有在成功转染的细胞中才能删除停止盒并开启红色tdTomato荧光(图5l)。Cre mRNA转染后2天后,观察到高效的器官选择性的基因编辑(图5m,5n)。
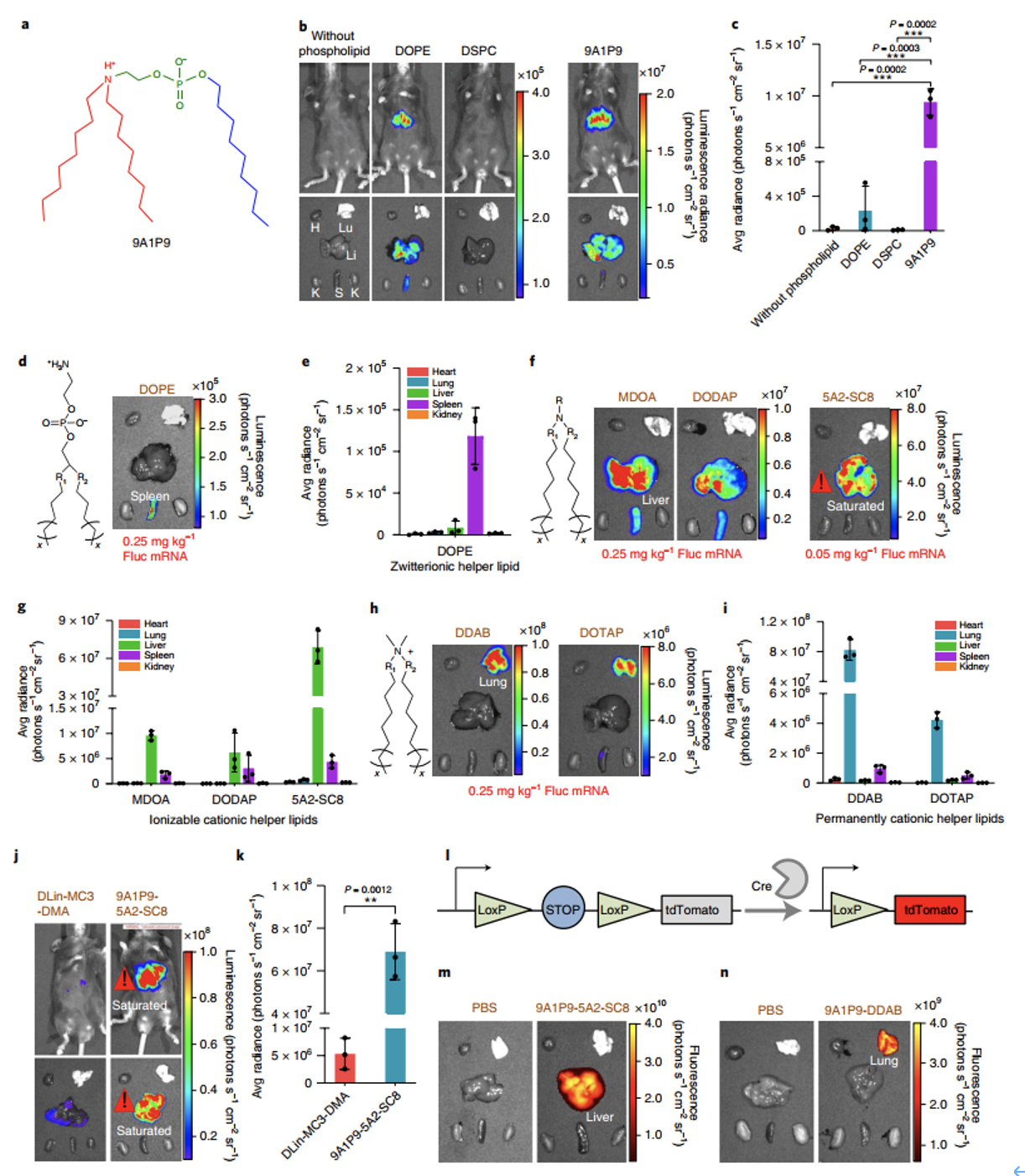
图5. iPhos优于传统的磷脂,并与不同的辅助脂类一起作用于器官选择性RNA传递。a, iPhos 9A1P9在酸性内体环境中的结构。b, c, iPhos 9A1P9和 DOPE与DSPC递送mRNA,肝脏荧光素酶表达的图像(b)和定量(c)。d, e,含有两性离子辅助脂质(DOPE)掺杂的iPLNPs介导脾脏mRNA表达成像(d)及定量(e)。f, g,含有可电离阳离子辅助脂质(MDOA,DODAP,5A2-SC8)的iPLNPs介导肝脏mRNA翻译表达成像(f)及定量(g)。h,i,含有永久性阳离子辅助脂质(DDAB, DOTAP)的iPLNPs诱导肺mRNA表达的脏器图像(h)和定量(i)。j,9A1P9-5A2-SC8与FDA批准的DLin-MC3-DMA脂类递送载体递送mRNA对比。m,9A1P9-5A2-SC8递送Cre蛋白mRNA后在肝脏处诱导tdTomato蛋白表达。n,9A1P9-DDAB递送Cre蛋白mRNA后在肺部诱导tdTomato蛋白表达。
具有翻译潜力的器官特异性CRISPR-Cas编辑:
特定器官的CRISPR-Cas9基因编辑一直是一个挑战,高效和器官选择性的基因编辑可能会拓宽iPLNP在多种遗传性疾病中的应用。作者利用iLNPs递送Cas9 mRNA和sgRNA用于基因编辑。分别用9A1P9-5A2-SC8和9A1P9-DDAB iPLNPs递送Cas9 mRNA和Tom1 sgRNA(sgTom1),以0.75 mg kg−1的总RNA剂量静脉注射到Ai9小鼠,删除停止盒,激活tdTomato蛋白(图6a)。9A1P9- 5A2-SC8 iPLNP给药后通过体外器官成像在肝脏中特异性检测到荧光td番茄蛋白(图6b),共聚焦荧光显微镜对器官切片分析显示肝组织中有tdTomato阳性细胞(图6d)。同样的,9A1P9-DDAB iPLNP递送Cas9 mRNA/sgTom1可以诱导肺部特异性基因编辑(图6c,6e)。随后,将磷酸酶和紧张素同源sgRNA (sgPTEN)与Cas9 mRNA共转染到C57BL/6小鼠中进行基因编辑,分别用9A1P9-5A2-SC8和9A1P9-DDAB iPLNPs递送,T7E1检测结果表明,该方法能有效地对肝、肺器官的靶基因进行编辑(图6f)。通过精确控制混合速度和体积比,可以制备较小的9A1P9-5A2-SC8 iPLNPs(77.2nm,肝特异性),9A1P9-DDAB iPLNPs (108.1nm, 肺特异性) 和10A1P16-MDOA iPLNPs (96.1nm, 脾特异性)。降低iPLNP直径后,体内mRNA传递效率和精确的器官选择性均得到充分保留(图6g,6h)。此外,iPLNPs可以重复递送给药,每次重复注射后都能保持高疗效(图6i,6j)。肝功能酶分析和组织切片组织学显示,这些iPLNPs在试验剂量下的体内毒性可以忽略不计(图6k)。这些结果突出了iPLNP系统在未来应用的潜力。
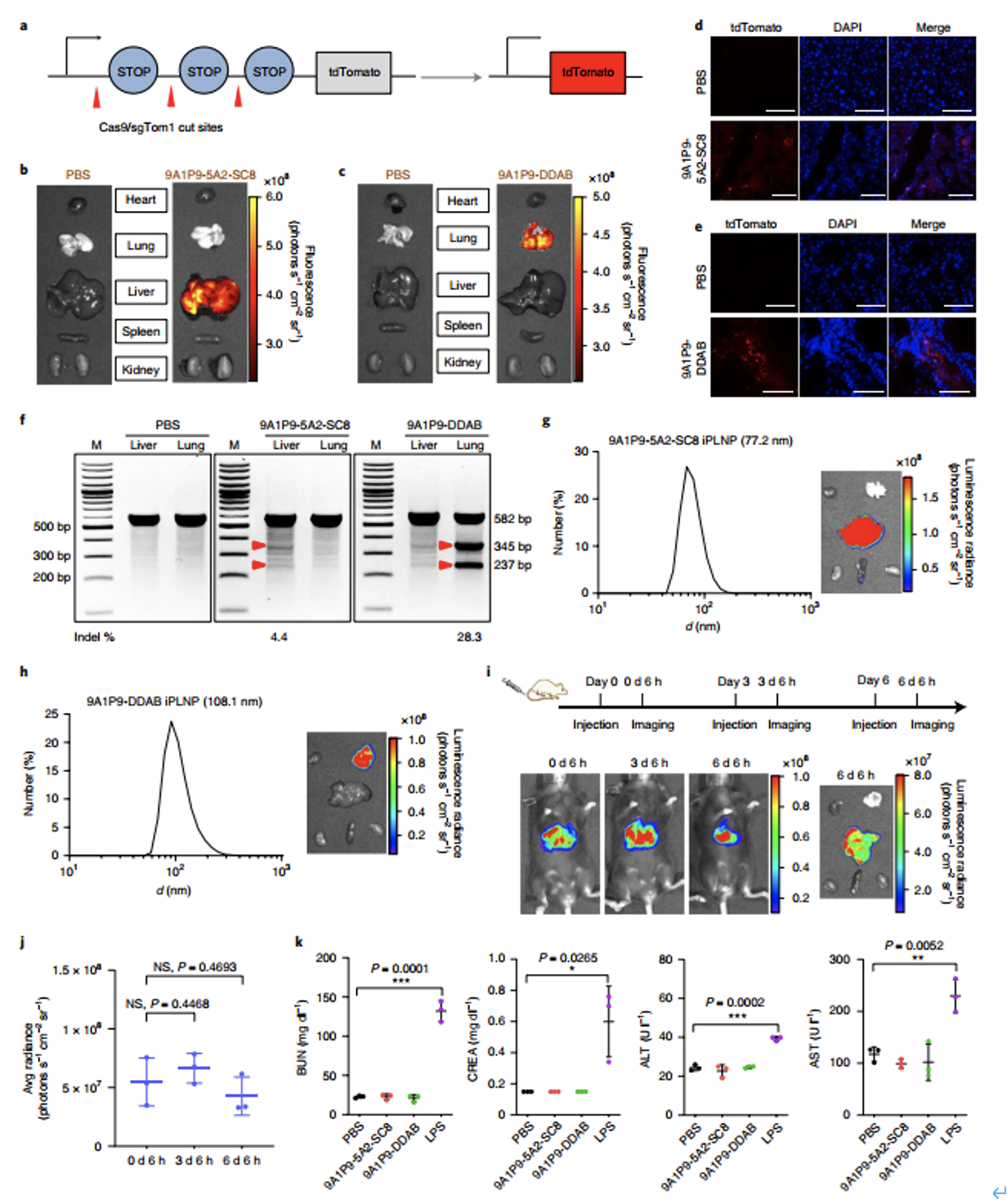
图6. PLNPs能够在肝脏和肺部选择性地进行CRISPR-Cas9基因编辑,并具有临床翻译的潜力。a, Cas9 mRNA和sgTom1删除停止盒并激活tdTomato蛋白的示意图。b, 9A1P9-5A2-SC8 iPLNPs使肝脏特异性的基因编辑成为可能。c, 9A1P9-DDAB iPLNPs使肺特异性基因编辑成为可能。d,肝脏中可见tdTomato阳性细胞。e,肺部切片可见tdtomato阳性细胞。f, 跑胶图可见特异性组织中基因编辑效果。g,更小尺寸的iPLNPs依然保持高效且特异的递送能力。i,iPNLs可以连续给药且不影响递送效果。J,k,9 A1P9-5A2-SC8和9A1P9-DDAB iPLNPs在体内耐受性良好。
总结:本文通过设计和合成iPhos脂质,以克服内体逃逸困难的挑战。优化的iPhos脂质包括一个pH值可调的小两性离子头和一个三尾体。这种独特的结构使得它很容易插入到自然发生的磷脂膜和诱导内体的膜的相变以增加RNA释放。构效关系显示iPhos链长可以控制体内mRNA传递效率和器官选择性。此外,在本文的iPLNP系统中评估了各种现有的两性离子、可离子化阳离子和永久性阳离子辅助脂质,该系统在脾、肝和肺中选择性地介导mRNA翻译。最终,使用9A1P9-5A2-SC8和9A1P9-DDAB iPLNPs递送肝脏mRNA和sgRNA以编辑报告基因和内源性基因,实现了具有长期挑战性的器官选择性CRISPR–Cas9基因编辑。结果证明合成的可电离磷脂有极大的希望用于治疗各种遗传疾病,并将副作用降至最低。
Shuai Liu , Qiang Cheng, Tuo Wei, Xueliang Yu, Lindsay T. Johnson, Lukas Farbiak, Daniel J. Siegwart . Membrane-destabilizing ionizable phospholipids for organ-selective mRNA delivery and CRISPR–Cas gene editing. Nature Materials 2021, doi: 10.1038/s41563-020-00886-0.

