NAT BIOTECH丨用基因编码的交换计时器测量酵母中的组蛋白替换动力学
作者:秦振恒
大家好,给大家推荐一篇近期发表在在《Nature Biotechnology》上的文章,题目是Measurement of histone replacement dynamics with genetically encoded exchange[1]。通讯作者来自以色列魏兹曼科学Naama Barkai教授,其主要研究DNA结合域(DBD),DNA或RNA结合蛋白以及本文所研究的组蛋白交换等生物回路原理方面的研究。
具有位置特意性标记的组蛋白与具有一般标记的组蛋白之间的组蛋白交换对基因调控具有重要意义,但对组蛋白交换的了解尚不完全。为了克服传统的选取时间点脉冲追踪组蛋白方法的时间分辨率差的问题,作者提出了一种基因编码的组蛋白交换的计时器,对两个带标签的的组蛋白的共定位于单个基因的时间具有测量功能。可以利用这些传感器可以绘制单个酵母样品中全基因组上的组蛋白交换模式。比较细胞周期G1中H3交换表明,非复制相关的H3交换每分钟发生几百次(占总1%),启动子部位交换率最高。作者观测到两个核心亚复合体之间的明显不同,H2A-H2B亚复合体在编码区域内进行快速转录依赖的替换,而H3-H4替换主要发生在启动子核小体区域,和基因激活或抑制相关。该计时器使得体内研究组蛋白交换动力达到了分钟的分辨尺度。
核小体是由147bp的DNA片段包裹在八聚体组蛋白周围形成,其中基因组与组蛋白的修饰和精准定位密切相关,并影响着核小体调控DNA相关的生物过程。组蛋白和DNA结合是动态的过程,组蛋白会发生交换更替,这就影响到位点特异性染色体修饰。尽管组蛋白交换对表观遗传很重要,但与组蛋白修饰酶相比,组蛋白交换在实验中受到的关注很少。研究组蛋白交换速率上存在局限。此前策略是在某时间节点上对组蛋白进行标记,以为为时间基点。这种“脉冲式”标记经常会存在时间的干扰和检测结果的延迟。此外,“脉冲式”检测会改变组蛋白水平,需要解析多个样本,对检测交换速度快的过程中具有局限性。
这里作者描述了一种替代的依赖于基因编码的传感器方法来分析组蛋白交换,设计了一个报告系统,报告系统对H2A-H2B二聚体和H3-H4四聚体的共定位很敏感。在细胞中这两个亚复合体共定位结合在DNA上形成核小体。因此,他们在给定基因组位置上的共定位报告了核小体在该位置的停留时间。
组蛋白交换传感器
感受器报告系统组成是,在感兴趣的组蛋白(例如,H3)的C端融合一个可被烟草蚀刻病毒(TEV)蛋白酶裂解的标记,和TEV蛋白酶融合到来自互补亚复合物的组蛋白亚基(例如,两个H2B等位基因之一)。可别TEV切割标记由HA和myc表位标签组成,中间由TEV切割位点连接。由于TEV裂解的概率与标记的亚基在DNA上的共定位时间成正比,myc水平仅在快速交换不断引入新和成的位点保持高水平(图1.a)。在停留时间较长的核小体中,myc别相关的TEV切掉,因此只剩下HA标签,报告了核小体的占用情况。
为了测试我们的感受器能否报告组蛋白交换,先将其应用于H3,此前全基因组交换速率是用脉冲式追踪方法测量的。验证标签不影响菌株的生长活性。为了评估TEV切割,我们还突变TEV位点来得到了不切割的菌株(NC),或减慢其速度(slow,切割速度降低26倍),并通过整体分析证实了体内切割的差异(图 1.b)。比较全基因组HA和myc图谱证实,在携带NC标记的细胞中,HA和myc水平在基因组之间高度相关。相反,在携带快速切割标记的细胞中,在HA水平较低和中等的核小体中也出现了高myc水平,这证实了该菌株的myc水平不仅仅又占据的核小体决定,还和核小体的替换有关(图 1.c)。
作者为了测试该传感器能否对组蛋白的交换进行报告,将myc和HA谱与通过脉冲追踪标记的H3测量的全基因组交换模式进行了比较。比较了所有核小体后,myc/HA比值与公布的已知的比值高度相关(图 1.d)。后边,又研究了组蛋白修饰与高myc/HA比值的相关性(图 1.e)。
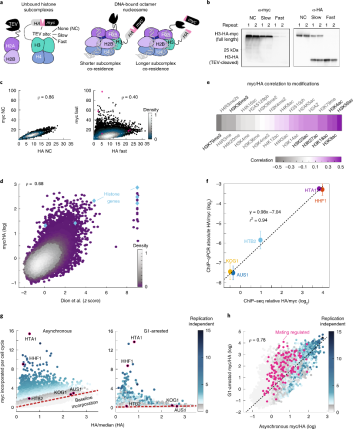
图1 组蛋白交换的基因编码计时器
估算非复制依赖的H3交换速率
上面的分析表明该传感器的方法可以用来测量组蛋白的交换模式。相比于脉冲模式没有时间上的延迟。尽管如此,这些数据可能会受到体内myc切割时间的限制,导致不能测更快的速率。为了估算myc的切割时间,进行免疫共沉淀和ChIP-qPCR测量,以确定在特定位点myc标记组蛋白的绝对分数。对比了myc/HA比率从基线到20倍范围的核小体,ChIP-qPCR反应的myc/HA比率差异性和测序结果成正相关的关系(图 1.f)。为了排除复制引入的核小体交换背景,选取G1停滞期的细胞,并通过测序测量了它们的myc/HA水平和qPCR表明基线交换减少了(图 1.g)。结论是,大多数(~90%)的核小体在每个细胞周期中只经历一次复制依赖的H3交换。再加上s期外组蛋白表达的估计(每分钟约500个核小体分子),使得我们可以将不依赖复制的H3交换近似为每分钟300-350个核小体(相比之下,每20分钟复制60000个核小体)。特别是,在HTA1和HHF1启动子区域发现的最高的交换率,对应的是平均每4min加入一个新的组蛋白,并平均停留~ 2min(图 1.h)。
H2A-H2B 和 H3-H4显示不同的交换模式
分析表明,不依赖复制的H3交换仅影响~10%的核小体。核小体的八聚体组装首先是H3-H4四聚体与DNA的结合,然后是再招募两个H2A-H2B二聚体。先前的研究表明H2A-H2B二聚体比H3-H4更容易交换。作者将分析扩展到包括所有四种核心组蛋白。为此,我们设计了携带H4、H2A和H2B交换传感器的菌株。myc和myc/HA在H3-H4和H2A-H2B亚复合物之间差异很大,但在同一亚复合物内的组蛋白之间更为相似(图 2.a)。为了开始分析这些差异,我们对基因的转录起始位点(TSS)进行了比对,并绘制了平均交换(myc/HA)信号(图 2.b)。为了分析这些差异,比对了基因的转录起始位点(TSS), H3-H4亚基的交换主要定位于基因启动子,而H2A-H2B交换发生在TSS下游(图 2c,d)。H2A和H3交换模式在所有这些菌株中几乎相同,证实了两个核小体亚复合物交换模式的差异与TEV融合位置无关。H2A-H2B亚复合物交换率预期比H3-H4亚复合物更高,细胞周期阻滞条件对基础交换水平的影响很小,这表明大多数核小体都经历了相当大的不依赖复制的H2A-H2B交换。估计H2A-H2B亚复合物交换率其范围是H3-H4汇率的8-40倍。
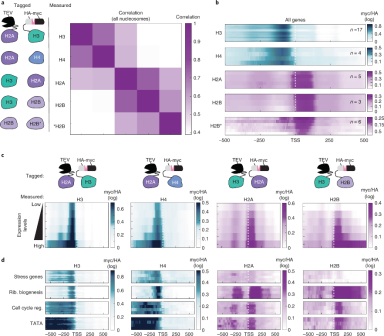
图 2 组蛋白在启动子部位进行H3-H4交换而基因体主要进行H2a-H2B交换
组蛋白合并、剔除和替换特征
前面展示了我们的交换传感器报告的myc/HA比率与脉冲追踪测量的汇率很好地相关性。作者推断个体myc和HA谱可能进一步提供核小体动力学的信息。提出是否能更精确地描述不同的生物属性或过程,如基因转录,如何影响组蛋白动态。模拟显示,在广泛的参数范围内,组蛋白的合并、剔除或替换的情况可以有不同的特征(图 3.a)。例如,核小体引入的增加的结果导致myc和HA的量协同增加。与合并不同的是高的置换增加myc水平,而HA水平保持不变,增加组蛋白剔除降低HA信号,对myc水平几乎没有影响。
作者利用组蛋白并入、剔除和替换的特征来检验基因表达对核小体动力学的影响。将核小体定位到基因,并根据相应基因的表达水平,绘制启动子或基因核小体的myc/HA水平(图 3.c)。在基因体内,H2A-H2B myc随基因表达增加而增加,而HA保持不变。这种替换特征表明,基因转录导致H2A-H2B替换。相比之下,H3(或H4)的myc和HA在大多数表达水平上基本保持不变。因此,在编码框架内,转录似乎促进了H2A-H2B的替换,而H3-H4大部分被保留。由于H3-H4携带大部分的转录相关标记,它在基因体内的保留可能是促进基因稳定表达的必要条件。
对于启动子核小体,我们观察到一个不同的模式。在这里发现替换特征与H3-H4亚基相关,而H2A-H2B交换基本保持不变(图 3.c)。组蛋白伴侣作为反义转录的阻遏因子发挥作用,观察到这种伴侣蛋白Spt6的过表达,H2A-H2B和H3-H4交换特征发生了反转(图 3.d)。
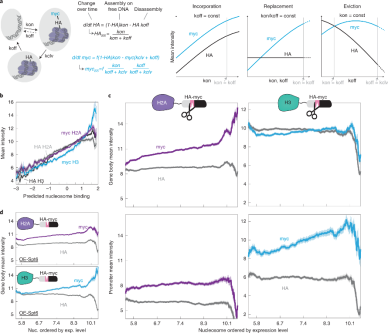
图 3 H2a-H2B和H3-H4替换与基因表达的行为差异
转录重编程过程中的组蛋白交换
我们的数据表明,H3-H4的替换定位于基因启动子,而H2A-H2B的替换是转录控制的。为了更直接地检验这一点,我们跟踪了转录重编程过程中的组蛋白动态。为此,我们将我们的H3和H2A交换传感器菌株暴露于氧化应激,并以5分钟为间隔绘制myc和HA谱图,持续70分钟(图4a)。
与稳定状态下观察到的特征一致,基因体核小体显示出转录依赖的H2A替换特征:myc信号在诱导基因上增加,在抑制基因上减少,而整体H2A丰度(HA)基本保持不变(图 4.a,b)。相反,H3从诱导基因中被剔除,这表明HA的减少。这些转录依赖的H2A替换和H3驱逐的差异特征在反应的所有阶段以及激活和抑制的基因中都被观察到(图 4.a)。我们也注意到H3在诱导基因的启动子中被剔除。这种驱逐在介导氧化应激反应的转录因子(TFs)结合位点周围区域最为明显:Msn2/4和Yap1。当基于实验定义的结合位点和启动子进行比对时,我们观察到H3(包括TFs)和H2A(仅Yap1)在这些结合位点周围的~500 bp区域内快速被剔除(图 4c)。剔除后,我们观察到H3显著增加。myc的增加是与转录因子位点上游的核小体特异性相关在靠近TSS的核小体中基本不存在,这可能表明TF结合或功能的不对称。此外,在结合Yap1的启动子中观察到类似的动态,表明基因表达在诱导应力下保持不变(图4.d)。
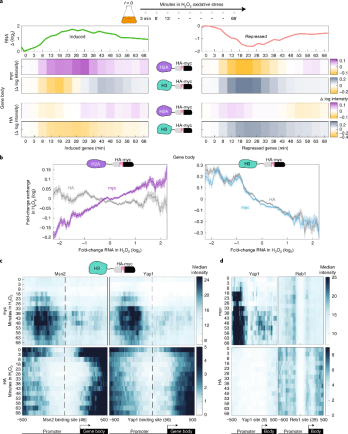
图 4 转录重编程过程中的核小体亚复杂动力学
H3-H4在高可塑性转录因子部位不断被取代。TF结合与H3启动子替换的强相关性表明,H3交换更多地与基因调控有关,而不是实际表达相关。前人研究表明,基因的表达可塑性(在不同环境条件或遗传背景下的表达差异)存在较大差异。高可塑性启动子在TATA盒中富集,TATA盒以前与快速组蛋白交换相关(图2.d)。为了检验这种关联是否仅限于表达基因,还是在基因抑制过程中也能观察到,对基因进行了排序。绘制启动子核小体myc和HA水平作为相关可塑性的函数,观察到激活和抑制基因的可塑性相关替换特征(图5.a)。值得注意的是,这个特征是针对H3-H4(而不是H2A-H2B)亚复合物的。
为了进一步测试H3快速替换与被抑制的启动子之间的关系,考虑组蛋白启动子,其中6个启动子显示最高的H3交换信号(图1.d)。这6个高交换组蛋白对应于被HIR (Hir1,2,3和Hpc2)和Asf1组蛋白伴侣抑制的3个组蛋白位点,它们与一个位于快速交换位点的负调控元件相结合。Kassem等人最近报道了抑制相关的H3启动子交换。通常删除Asf1, Hir1和Hir2导致myc信号在调控组蛋白基因启动子处的强烈下降(图5b,c)。
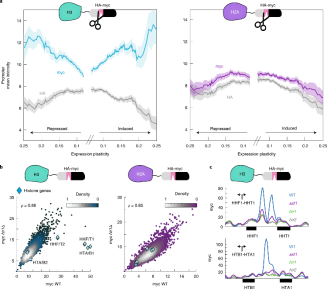
图 5诱导和抑制基因都显示高连续的启动子H3替换
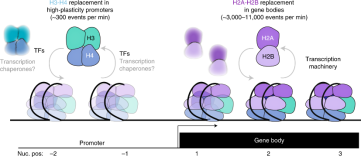
图 6 H2A-H2B的快速替换主要发生在基因体中, H3-H4置换发生在调控基因的启动子中

