SCI TRANSL MED丨Syn-Notch CAR-T在治疗恶性胶质瘤中具有特异性、异质性及持续性
作者:田园

文章通讯作者是加州大学旧金山分校的合成生物学家Wendell Lim。

作者通过改变Notch的细胞外识别结构域来定制输入感测,包括使用基于抗体的结构域(例如单链抗体或纳米抗体)来检测各种特定的细胞表面蛋白,例如 作为疾病的抗原。 同时,我们可以通过交换细胞内转录域并提供特定的下游效应靶基因,将这些特定的输入与特定的响应联系起来。 最终的合成Notch(Syn-Notch)受体仅保留了天然Notch的最小跨膜核心结构域,该结构域介导了蛋白水解的控制。 这些Syn-Notch受体在多种细胞中起作用,包括免疫细胞和神经元。
作者在这份研究中设计了一种新的CAR-T细胞,能同时识别多种抗原。在之前的研究中,作者发明了prime-and-kill电路CAR-T细胞。这种CAR-T细胞也能被认为是IF-Then电路,也就是说,这些CAR-T细胞识别的第一种抗原使其初始化,从而表达的car能杀死表达第二种抗原的肿瘤细胞。作者在这份工作中完成了两项工作,第一份工作中,Syn-Notch CAR-T能识别胶质瘤高表达的EGFRvIII变体,从而被初始化,继而开始识别胶质瘤高表达另一种抗原,也就是EphA2和IL13Ra2,从而杀死胶质瘤细胞;在第二份工作中,Syn-Notch CAR-T细胞首先会被中枢神经系统特异性抗原MOG所初始化,继而高表达car能识别EphA2和IL13Ra2。
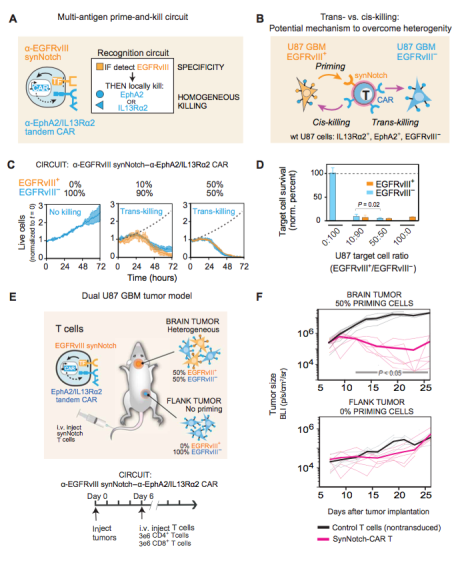
图1 T 细胞的多抗原激活和杀伤电路提供了克服抗原异质性同时仍保持高肿瘤特异性的通用策略。
在作者的第一份工作中,作者设计的Syn-Notch识别的肿瘤特异性抗原,EGFRvIII是胶质瘤特异性的,但这个抗原并不均质。为了达到均一化的抗肿瘤效果,作者构建的IF-and-Then电路,当Syn-Notch CAR-T细胞识别到EGFRvIII后,会诱导CAR的表达,表达的CAR能识别EphA2和/或IL13Ra2(图 1 A)。
作者又提出了两种概念,顺势抗肿瘤和反式抗肿瘤(图 1B)。顺势抗肿瘤的意思是,当Syn-Notch CAR-T被一种肿瘤细胞的抗原所激活,然后去杀死另一种不表达该抗原的肿瘤细胞,即为顺势;而反式抗肿瘤则是,当Syn-Notch CAR-T被一种肿瘤细胞的抗原所激活,然后继而杀死该肿瘤细胞。作者认为他设计的synntch即为顺势抗肿瘤效果。为了验证作者设计的IF-and-then电路为顺势作用的,作者构建了U87胶质瘤模型,U87胶质瘤细胞本身高表达EphA2和IL13Ra2,但不表达EGFRvIII变体,作者构建了高表达EGFRvIII肿瘤细胞,然后将高表达EGFRvIII变体的细胞和野生型EGFRvIII细胞按不同比例共培养,从而模拟肿瘤患者体内的胶质瘤的异质性,再测试Syn-NotchCAR-T细胞的抗肿瘤活性。在体外实验中,作者发现只要存在EGFRvIII高表达肿瘤细胞,这种Syn-NotchCAR-T就能被有效激活并杀死野生型胶质瘤细胞(图1C,1D)。
接下来作者进一步测试在体内实验中Syn-Notch CAR-T的效果。作者构建了胶质瘤小鼠模型,作者将EGFRvIII变体高表达细胞和野生型细胞1:1混合种植到小鼠脑部。作者另外还在小鼠背部种植了野生型胶质瘤(图1E)。在这种模型中,小鼠脑部的肿瘤既带有初始化抗原和抗肿瘤抗原,而小鼠背部的肿瘤仅带有抗肿瘤抗原。在肿瘤种植后的第六天,小鼠尾静脉注射了Syn-Notch CAR-T细胞。结果显示,Syn-Notch CAR-T治疗显著减少了小鼠脑部的肿瘤,而对小鼠背部的肿瘤没有效果。
作者进一步分析了肿瘤异质性对Syn-Notch CAR-T的影响。作者发现,和小鼠脑部带50%EGFRvIIII高表达细胞相比,小鼠脑部种植100%EGFRvIII变体高表达细胞的肿瘤组中的Syn-Notch的抗肿瘤活性是一样的,也就是肿瘤都得到了相同程度的缓解。

图2 SynNotch-CAR T细胞在清除GBM6 PDX 肿瘤方面显示出比单独的亲本持续性 CAR-T更高的功效和耐久性
接下来作者采用PDX模型来验证Syn-Notch的效果。作者首先采用流式验证他获得的这个PDX表达的EGFRvIII是异质性的。流式结果显示有明显两个峰(图 2A)。作者将PDX种植在小鼠脑部。对照组小鼠(注射了野生型T细胞的小鼠)在肿瘤种植后的43天死光了;采用传统CAR-T治疗的小鼠的肿瘤基本没有缓解(图 2C and D),这个结果和之前的临床试验结果一致。然而所有接受syn Notch CAR-T治疗的小鼠肿瘤都得到了长效的缓解。作者进一步将小鼠的脑部取出,并进行切片分析。在CAR-T治疗第15天,传统CAR-T治疗组中,小鼠脑部的T细胞没有残留,所有的胶质瘤细胞都是EGFRvIII低表达的肿瘤细胞(图 2G)。而Syn-Notch对照组中,Syn-Notch CAR-T细胞在脑部存在并且胶质瘤细胞已经被完全清除(图 2G)。上述的这些试验显示,以IF-and-then电路设计的Syn-Notch CAR-T能实现更准确且更完全的抗肿瘤效果,比抗单一抗原的CAR-T更有效。
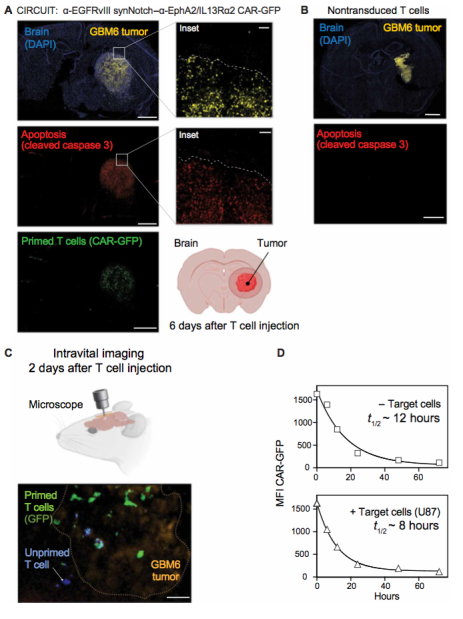
图3 时间点成像显示,synNotch-CAR T 细胞的启动和杀伤精确地限于肿瘤区域。
进一步,作者为了更精细的分析Syn-Notch CAR-T的治疗效果,作者取出了仅使用Syn-Notch CAR-T治疗6天的胶质瘤小鼠的肿瘤。胶质瘤细胞用mCherry标记了,而Syn-Notch CAR-T用GFP标记。作者发现Syn-Notch CAR-T细胞和胶质瘤细胞是共定位的(图 3A)。对照组,也就是野生型T细胞组则对肿瘤细胞没有杀伤效果 (图 3B)。为了更直接地观察 T 细胞初始化,作者还在 T 细胞注射后 2 天进行了活体成像(图 3C)。 这些延时电影显示大量仅在肿瘤内初始化的 T 细胞,以及在接近肿瘤时才开始初始化的未初始化的 T 细胞。 结果显示,在长达 1 小时的观测过程中,引发的 T 细胞保持稳定地定位在肿瘤内,这可能是因为 T 细胞与靶细胞相互作用。另一个可能有助于高空间靶向特异性的特征是,当细胞离开带有引发抗原的微环境时,Syn-Notch 诱导的 CAR 表达将停止,并且 CAR 蛋白将衰减。 在去除长期启动细胞刺激后,作者使用 GFP 标记的 α-EphA2/IL13Rα2 CAR 测量了 CAR 蛋白衰减(图 3D)。
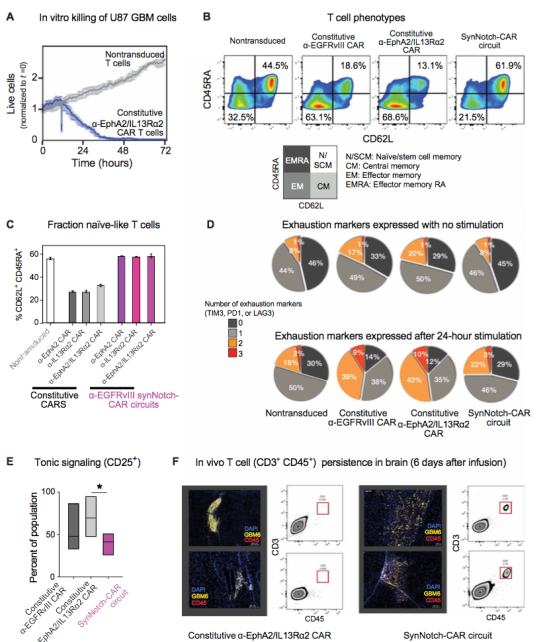
图4 SynNotch-CAR T 细胞显示出增强的初始/干细胞记忆表型、减少的衰竭和改善的体内持久性。
在体外实验中传统的CAR-T对胶质瘤的杀伤效果很好(图 4A),但是体内实验中,Syn-Notch CAR-T的效果更好,能显著清除肿瘤。这些矛盾的结果让作者继续探究Syn-Notch的优势。
既往CAR-T治疗实体瘤的面临的挑战是T细胞的耗竭,这是体内实验效果比较差的原因,作者继而检测了Syn-Notch CAR-T的一些T细胞表型,他发现这些T细胞的表型更倾向于初始T细胞(图 4B),并且激活后的Syn-Notch T细胞表达更多干性分子包括CD62和CD45(图 4C)。采用胶质瘤细胞激活Syn-Notch T细胞后,该细胞表达的耗竭因子也比对照组少很多,既往研究显示持续性表达CAR会使得T细胞耗竭,作者推测Syn-Notch T由于没有被持续性激活因此其耗竭的少。作者检测了CAR激活标记CD25,发现确实Syn-Notch T的CD25表达明显少于传统的CAR(图 4E)。进一步作者在体内实验明确了,在注射Syn-Notch T 6天后,小鼠的脑补的T细胞比传统CAR-T多很多。
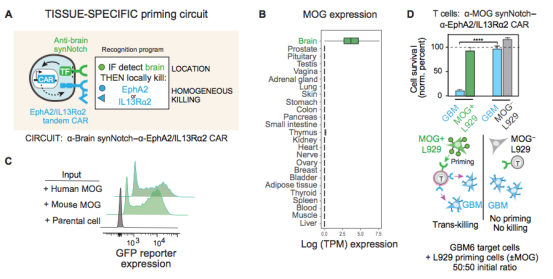
图5设计脑抗原引发的 SynNotch-CAR 电路以靶向 GBM。
考虑到Syn-Notch T细胞的顺势杀伤活性,作者推测Syn-Notch T可以做到被正常组织所激活,然后不杀伤正常组织,而在遇到肿瘤细胞后杀伤肿瘤细胞。这样的Syn-Notch T细胞可以做成组织特异性的,也就是Syn-Notch T被组织特异性抗原所激活,然后再杀伤肿瘤细胞(图5A)。作者通过生信分析发现脑部高表达MOG蛋白,可作为组织特异性抗原。作者构建了能被MOG蛋白初始化的mog Syn-Notch T细胞,图 5C显示,人和鼠的MOG蛋白都能诱导Syn-Notch的表达。体外实验证实,Syn-Notch T有杀伤肿瘤的效果。
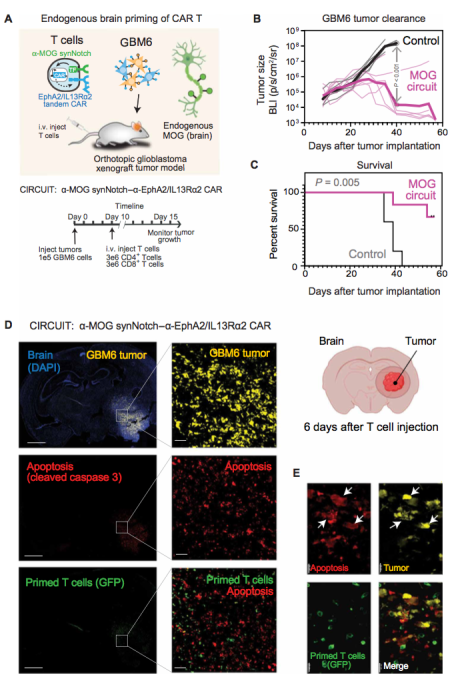
图6 通过脑特异性抗原 MOG 对 synNotch-CAR T 细胞的组织特异性引发诱导体内 GBM6 脑肿瘤的有效杀伤
最后,作者构建了小鼠模型,小鼠脑部种植有胶质瘤,脑部组织本身表达MOG蛋白,再种植瘤子第10天后,注射Syn-Notch T细胞(图 6A)。结果显示 60天内小鼠瘤子得到显著缓解,而且生存率得到极大提升(图 6B and C)。Syn-Notch T具有肿瘤特异性的富集。

