NAT NANO丨通过人工金属酶催化的信号处理改变DNA原始生命系统功能及形态
作者:徐锐
今天给大家分享是近期发表在“Nature Nanotechnology”上的一篇文章。题目为“Functional and morphological adaptation in DNA protocells via signal processing prompted by artificial metalloenzymes”。文章的通讯作者分别是来自University of Freiburg大学的 Andreas Walther教授和来自University of Basel大学的Thomas R. Ward教授。Andreas Walther教授的研究方向主要为纳米材料的自组装和可再生纳米纤维素/纳米壳聚糖及其应用。Thomas R. Ward教授的主要研究方向为利用生物纳米技术进行人工金属酶的构建筛选并且应用到合成生物学中构建代谢通路。
宇宙中生命体的出现与原始细胞的胞内环境中发生的催化反应密切相关。如今,细胞和生物体通过反映网络来处理信号并作出相应的行为,最终影响下游功能和结构形态。在新设计的原始细胞中重构这样的信号处理过程是一个巨大的挑战,但是这对于理解和构建像生命体一样的具有自适应功能的人工细胞系统却又至关重要。作者设计了一种全DNA原始细胞,其可以招募具有烯烃复分解反应催化活性的人工金属酶,从而导致该原始细胞对不同复杂水平的事件做出反应,改变细胞形态。人工金属酶催化释放荧光信号分子,该分子产生的一种自报告荧光代谢产物可以减弱DNA双链之间的作用。这就使得DNA原始细胞在有这个的荧光分子存在下,其大小、形态及内部一些特定的功能发生改变。这样的过程模拟了在细胞自适应和细胞与细胞间粘附发现的化学转导过程。作者提出的这一概念展示了在合成的原始细胞中通过非生物的方式实现了生物正交的化学和机械转化。此外,它揭示了一种在适应性和沟通性的软物质微系统中诱导复杂行为的策略,并阐明了如何在微隔室化介质中上调和维持动态特性。
可能是通过空间上液-液相分隔的无膜细胞器,使得活细胞拥有用反应网络在拥挤的环境中处理不同信号的能力。近年来,(生物)聚合物已成为优选的原始细胞的模型系统。那些对细胞功能所必需的关键特征:大分子拥挤和相分离。作者设计了一种在全DNA形成的原始细胞中利用基于生物素-链霉亲和素的人工金属酶方法,将非DNA信号输入,引起原始细胞功能和形态响应的体系。作者将两条通过滚环扩增(RCA)得到的单链DNA(分别为p(A20-m)和p(T20-n))以不同比例混合,在热引导相分离使得其形成表层为DNA水凝胶,基质为液体DNA单链的全DNA原始细胞。A20和T20分别代表20个重复的腺嘌呤和20个重复的胸腺嘧啶。m和n为这些序列所能够功能化的条形码。人工金属酶(ArM)通过链酶亲和素与带有生物素的单链DNA序列互补到m条形码处,从而实现的ArM的固定。文中所用金属酶ArM可以通过开环易位(RCM)触发荧光信号前体释放,从而对体系产生影响。
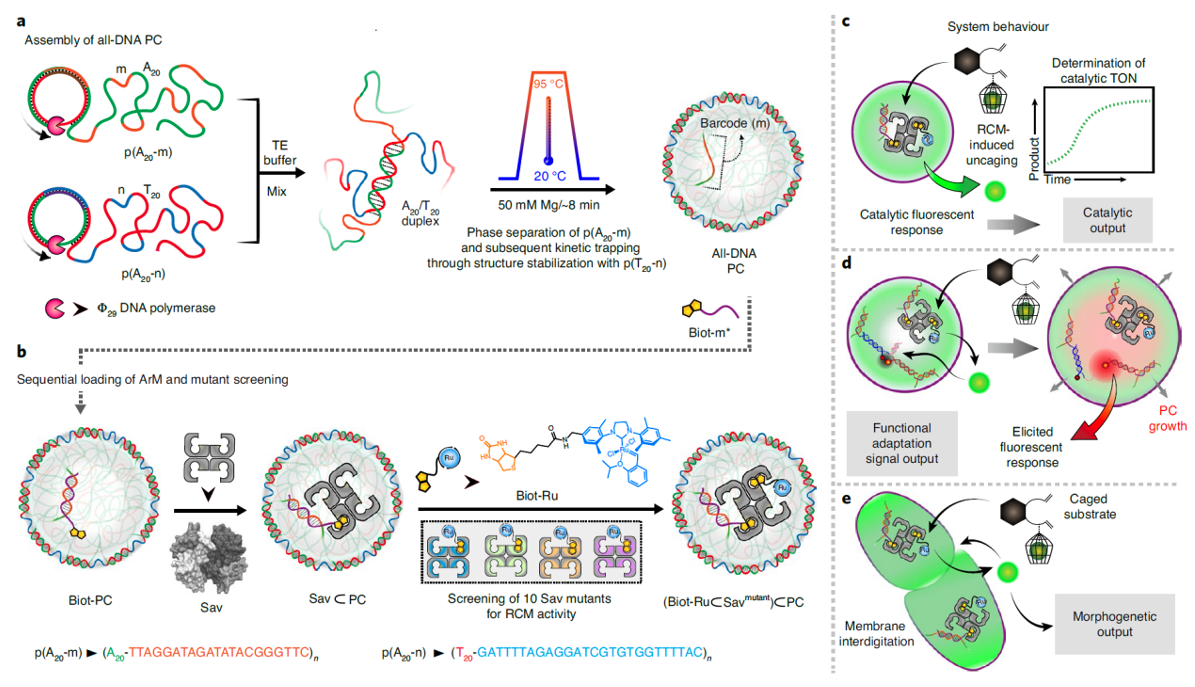
图1. 设计理念、策略以及ArM催化的信号转换对全DNA原始细胞的影响。
接下来,为了验证未经修饰的原始细胞和载入链酶亲和素的原始细胞(Sav⊂PCs)的物理状态,作者设计了光漂白后荧光恢复试验。单个未经修饰的原始细胞在辐射和未辐射内核区域几乎同时被漂白,且重复的光漂白会导致整个原始细胞全部漂白。这样的现象可以说明此原始细胞的是由水凝胶状的外壳包裹液体状内核组成的。相反,Sav⊂PCs的内核和外壳在单次光漂白实验后荧光几乎不恢复。并且非辐射区的荧光强度比初值只降低了20%左右。这就说明链霉亲和素是p(A20-m)/Biot-m*之间的交联剂,且这使得原始细胞内核形成了胶状。

图2. 区室选择性功能化的原始细胞。
为了监测人工金属酶介导的RCM反应在原始细胞内核中是否发生,且能够通过释放荧光分子前体完成信号转化。作者利用两种含有二烯烃的底物。这两种化合物均有自我报告及其产物可以和DNA相互作用的功能。(1)一种是可以释放羟基香豆素的萘的前驱体;(2)另一种是在RCM反应通过消除水后形成二甲氧基萘的前驱体。其中香豆素的衍生物,例如羟基香豆素,可以嵌入到DNA双链中,特别是A/T。作为进一步猜想,二甲氧基萘同样可以通过疏水作用力和π堆积来影响DNA双链。同时作者利用此体系从多种突变的人工金属酶中做了筛选,发现在原始细胞内的ArM的催化效率要比游离的ArM高出至少三倍。作者认为这得益于拥挤的原始细胞内核提供的区室化效应。
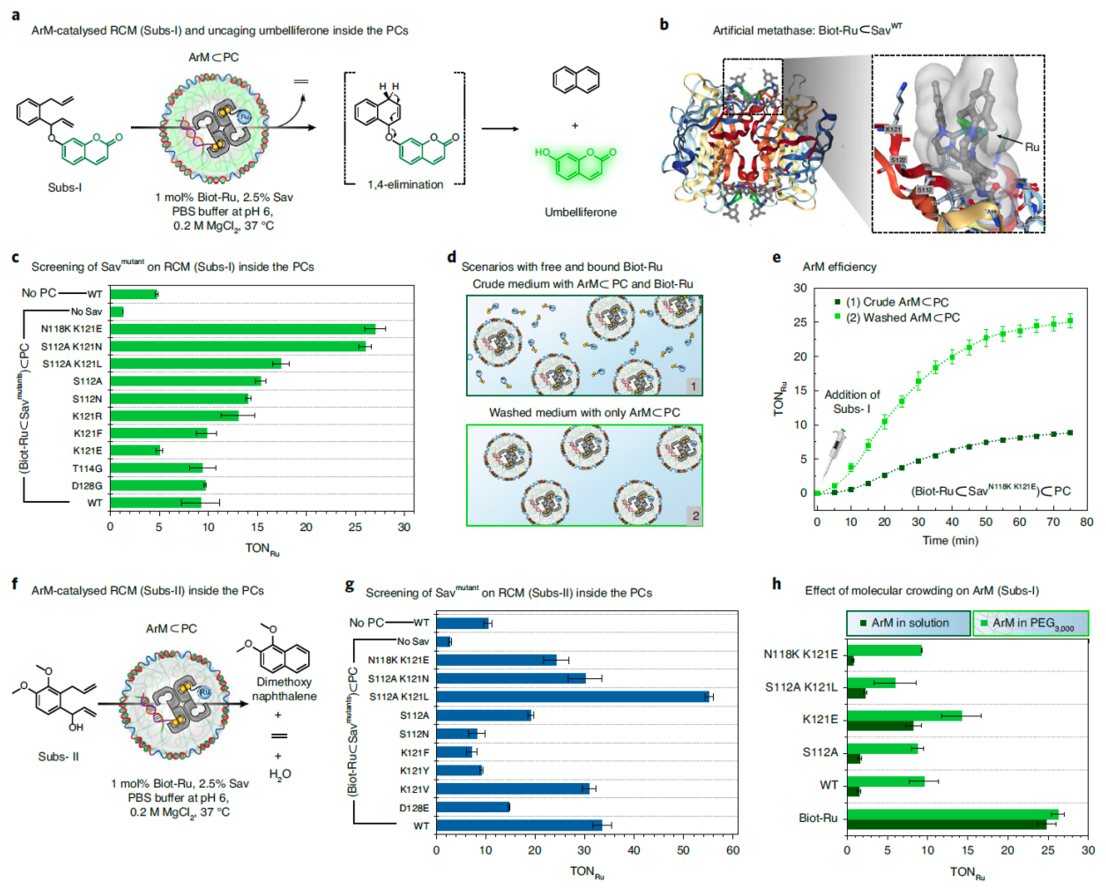
图3. 基因工程构建的不同ArM对底物I和底物II在原始细胞内的催化效率。
最终作者在原位显微成像研究中心分别选择了对底物I和底物II催化活性最高的两种人工金属酶系统-(Biot-Ru⊂SavN118K K121E)⊂PC/Subs-I和(Biot-Ru⊂SavS112AK121L)PC/Subs-II。为了监测DNA原始细胞对该催化活性所做出的的下游反应,作者将两种系统相混合。当注射底物I时,原始细胞内核产生绿色荧光,以此证明区室化包裹的ArM成功催化了RCM反应,并在胞内释放出羟基香豆素,并且观察到了细胞直径增大了5倍,体积增大了125倍。绿色荧光逐渐在胞膜上积累,在胞外不可见,证明了羟基香豆素紧密地结合在DNA双链区域。同时,胞膜原本的红色荧光强度在反应发生一小时后降低了50%。

图4. 激光共聚焦监测原始细胞内部ArM催化的RCM反应并且使得细胞形态发生变化。
作者进一步猜想是不是更高的底物浓度以及延长反应时间会使得细胞膜破裂,并且会导致细胞之间的相互作用。当增加三倍底物浓度时,观察到细胞的融合现象。该现象的发生是由于细胞生长引起的对称性破裂,最终导致不同细胞内核之间发生相互作用。作者认为:因为在链酶亲和素的作用下,细胞内核呈现出胶体状,因此内核并不会像液体一样流出来。除此之外,不同内核之间同样会发生生物素-链霉亲和素反应以及因为疏水作用使得内核之间发生了融合现象。
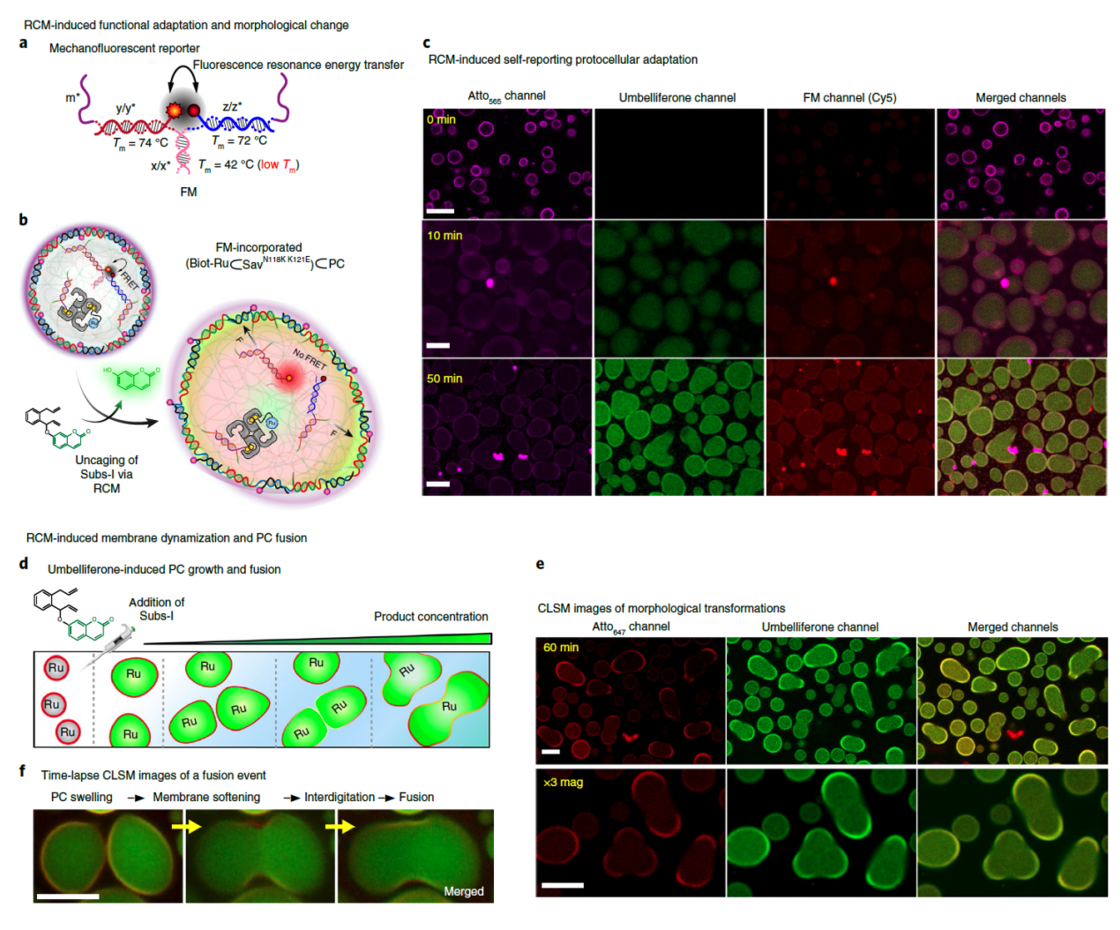
图5. RCM反应引起的自报告荧光,下游功能性适应及形态变化。
综上所述,作者通过本篇文章介绍了一种在ArM包裹进全DNA形成的原始细胞中的方法。并且通过催化反应将非DNA信号成功地转化为下游的功能和形态变化,如原始细胞生长,分裂,融合。在人工原始细胞向活细胞模拟的研究领域跨出了重要一步。
Samanta A, Sabatino V, Ward TR, Walther A. Functional and morphological adaptation in DNA protocells via signal processing prompted by artificial metalloenzymes. Nat Nanotechnol. 2020, 15(11): 914-921. doi: 10.1038/s41565-020-0761-y.

