CELL丨开发CRISPR抗病毒策略用于对抗SARS-CoV-2和流感
作者:郑婷婷
SARS-CoV-2病毒正在引起全球冠状病毒病(COVID-19)的大流行,目前尚无预防性疫苗或经过验证的药物治疗。随着世界范围内死亡人数的迅速增加,需要灵活而有针对性的保护手段来抑制该疾病的发生。最近的一份报告显示,具有不同基因组序列的两种SARS-CoV-2菌株(L和S)正在传播并且可能在进化,这凸显了针对泛冠状病毒靶向策略的需求。
斯坦福大学的亓磊教授及其合作者开发了一种基于CRISPR的策略用于病毒抑制——PAC-MAN(人体细胞中的预防性抗病毒CRISPR),将其作为针对SARS-CoV-2、A型流感病毒(IAV)以及所有可能的冠状病毒基因的干预策略。并创建了一条生物信息学流水线以定义已测序的SARS-CoV-2基因组中的高度保守区域,使用CRISPR-Cas13d靶向这些区域进行病毒基因序列降解。
SARS-CoV-2属于正义RNA病毒家族,其生命周期可能类似于SARS冠状病毒,在SARS中,病毒进入细胞,将其RNA基因组释放到细胞质中,并合成负义基因组和亚基因组RNA,病毒mRNA及合成和组装病毒的新复制体(图1 A)。大多数正在进行的疫苗试验都是通过启动人类免疫系统来识别冠状病毒蛋白或减毒病毒并减少病毒进入细胞而起作用的。作者在此提出的另一种抗病毒方法依赖于基于CRISPR的系统来识别和降解细胞内病毒基因组及其产生的病毒mRNA,以限制病毒复制(图1B)。
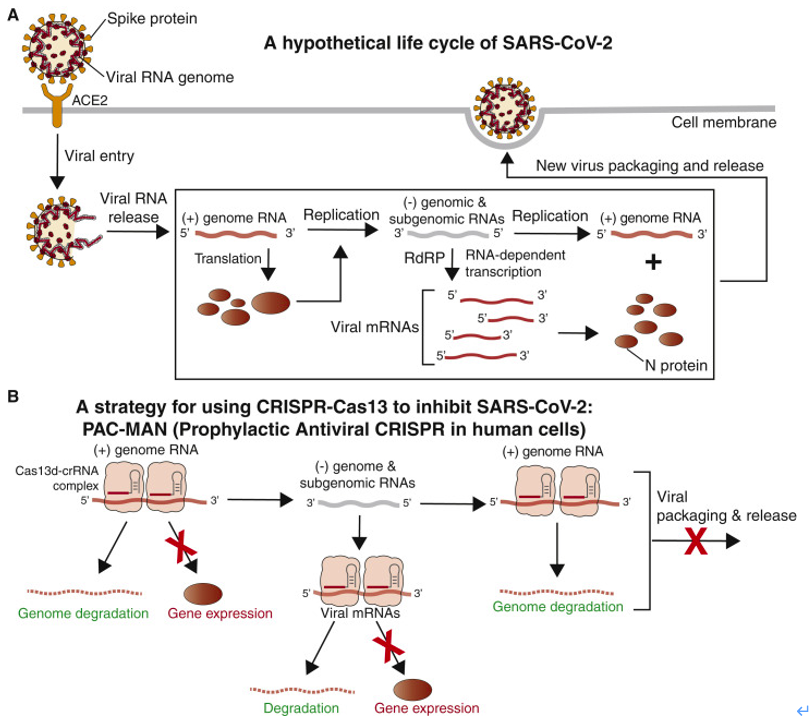
图1. SARS-CoV-2的假想生命周期和用CRISPR-Cas13抑制冠状病毒的PAC-MAN策略
为了创建能够有效和特异性靶向和切割SARS-CoV-2基因组的CRISPR相关RNA(crRNA)序列,作者首先通过比对已公开发表的SARS-CoV-2基因组及来自47名SARS-CoV和MERS-CoV患者的基因组,进行了生物信息学分析。SARS-CoV-2具有约30,000 nt的单链RNA基因组,编码12个假定的、功能性开放阅读框架。经过分析发现SARS-CoV-2菌株以及47个SARS-CoV和MERS-CoV基因组之间具有高度保守性的区域(图2A)。其中两个保守度较高的区域包括位于多肽ORF1ab区维持所有冠状病毒增殖的RNA聚合酶(RNA polymerase, RdRP)基因和位于基因组3’端编码病毒包装衣壳蛋白的核衣壳(nucleocapsid, N)基因(图2 A)。
为了靶向高度保守的SARS-CoV-2区域,设计并合成了40条crRNA,其中20条crRNA分别针对RdRP和N基因的保守序列,这两个区域的降解能够显着减少用于表达病毒必需蛋白的基因组、亚基因组RNA和mRNA模板。同时,作者还创建crRNA组,以防止突变逃逸导致的靶向能力消失。
为了评估Cas13d对于靶向SARS-CoV-2序列是否有效,作者创建了两个报告基因,它们表达了与GFP融合的SARS-CoV-2合成片段(SARS-CoV-2-F1和SARS-CoV-2-F2)(图2B)。由于SARS-CoV-2主要感染患者的呼吸道细胞,作者选择使用人肺上皮A549细胞作为模型细胞系。并创建了通过慢病毒感染稳定表达Cas13d的A549细胞系,然后分选出带有与Cas13d共表达的mCherry标记的细胞(图2C)。
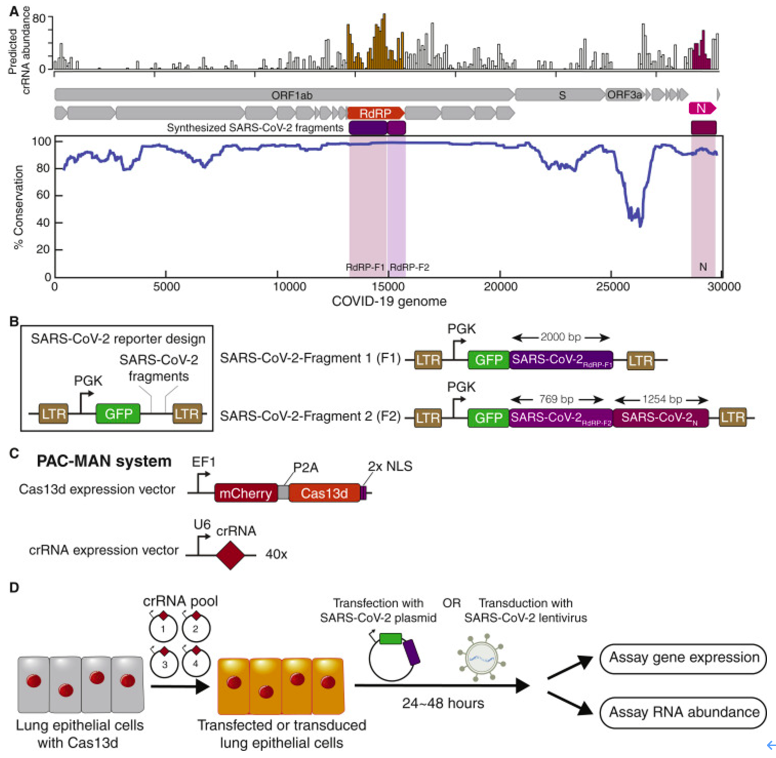
图2. SARS-CoV-2的Cas13d目标位点的生物信息学分析和PAC-MAN系统的构建
作者首先研究了SARS-CoV-2基因片段的哪些区域最容易受到Cas13d介导的靶向和切割的影响。将SARS-CoV-2报告基因转染或转导到Cas13d A549细胞中,该细胞已预先转导四种靶向RdRP或 N基因区域的crRNA组(图2D)。作者选择使用crRNA组评估系统的有效性,避免在活病毒感染的情况下,由于单个crRNA目标位点发生突变而逃逸的可能性,作者将所有40种crRNA分成十组(G1-G10)测试。SARS-CoV-2报告基因转染后二十四小时,通过流式细胞术检查GFP蛋白表达的水平,并从细胞中收集RNA进行实时定量PCR以检查mRNA转录物的丰度。
与对照相比,大多数靶向RdRP的crRNA组都能在一定程度上抑制报告基因的表达,并且靶向SARS-CoV-2-F1 RdRP片段中心区域的G4组效果最好,能够抑制86%的GFP表达(p = 2×10-6)(图3A)。靶向N基因的crRNAs组G6能够抑制71%的SARS-CoV-2-F2的GFP表达(P = 2×10-7)(图3B)。实时定量PCR分析显示了在RNA表达水平上结果一致,G4和G6将分别抑制了83%(p = 3×10-11)和79%(p = 2×10-12)它们各自报告的mRNA丰度(图3A和3B)。不同crRNA组抑制SARS-CoV-2报告基因的能力差异可能是由于SARS-CoV-2基因组片段固有的RNA二级结构或每种crRNA序列组成的结合亲和力不同所致。
接下来,通过慢病毒转导引入SARS-CoV-2-F1或SARS-CoV-2-F2以模拟天然COVID-19感染的crRNA靶向条件。作者测试了一些选定的crRNA组,包括三个效果最佳组G4,G5和G6和一个效果较低的G1组,慢病毒感染复数MOI为0.5。结果显示与SARS-CoV-2转染实验相似,最佳组(G4,G5,G6)能够分别抑制69%,71%和60%的GFP表达(图3C),及70%,68%和49%的RNA丰度(图3D)。靶向RdRP或N的crRNA能够分别抑制其相应的报道分子81%(p = 0.01)或90%(p = 5×10-4)(图3E)。
这些数据共同表明:(1)Cas13d PAC-MAN有潜力成为靶向和降解人细胞中SARS-CoV-2基因的有效策略,并且(2)crRNA的正确设计可获得高效SARS-CoV- 2抑制。

图3. PAC-MAN可以抑制SARS-CoV-2基因的表达
由于作者无法获得活的SARS-CoV-2病毒,因此选择引起A型流感病毒(IAV)的H1N1病毒来测试该策略,H1N1病毒具有与SARS-CoV-2相似的嗜性。与仅具有一个连续的RNA基因组的SARS-CoV-2相比,IAV基因组包含在八个负义RNA片段中,其中每个片段在将病毒RNA包装成萌芽的病毒体中都起着重要的作用。作者使用来自约140种不同流感病毒株的序列进行生物信息学分析得出了针对八个IAV片段中每个片段的高度保守的基因组区域的六个crRNA,总共48个crRNA。
为了测试靶向IAV的crRNA组的作用效率,作者在稳定表达Cas13d的 A549细胞系中进行了crRNA组的筛选,以确定哪种对抑制IAV感染最有效(图4A)。在所有crRNA中,靶向神经氨酸酶(NA,介导新病毒粒子萌发所必需的病毒表面蛋白)的crRNA组S6在不同的MOI中抑制效果最一致且可靠(MOI = 2.5降低72%,MOI = 5降低52%)。作者进一步表征了靶向S6的crRNA组,对mNeon +Cell进行了显微镜定量分析,发现S6的MOI为2.5和5时,mNeon表达分别降低了62%(p = 10-5)和73%(p = 5×10-9)(图4B),流式细胞术也证实了这一趋势(图4C)。结果表明,Cas13d PAC-MAN能够靶向高度保守的病毒区域,并强有力地抑制人肺上皮细胞中的病毒复制。
作者分析了91,600个具有完整片段序列的菌株,以鉴定所有可能的crRNA,并完善了此列表以定义可靶向尽可能多的IAV基因组且没有错配的最小数量的crRNA。分析表明,一组81个crRNA可以覆盖所有91,600个IAV,而最少的六个crRNA可以靶向92%的IAV基因组(图4D),表明该方法可能是泛IAV定位策略。

图4. PAC-MAN可以抑制肺上皮细胞的感染
在过去的二十年中,冠状病毒的多种变种(包括引起COVID-19,SARS和MERS的变种),每次造成大量死亡。因此,设计一种可以广泛地针对和预防病毒威胁的策略,包括目前生活在动物体内的所有冠状病毒株,将是一种宝贵的资源。因此,作者希望设计出最少数量的可靶向人和动物体内大多数已知冠状病毒的crRNA,从而针对特定病毒家族提供更高效的预防效果。为此,作者分析了所有已知的冠状病毒基因组(3,051),以鉴定可能靶向每个基因组的可能的crRNA,最终产生约648万种可能的crRNA(图5)。并对该列表进行了细化,以找出可靶向所有已知冠状病毒基因组的最小数量的crRNA。结果发现只需2个crRNA即可靶向约50%的冠状病毒基因组,包括引起COVID-19,SARS和MERS的基因组;6个crRNA能够靶向约91%的冠状病毒基因组;22种crRNA涵盖了所有测序的冠状病毒,且没有错配(图5B)。与传统的药物或疫苗接种方法相比,该策略可使用相对少量的crRNA可广泛靶向大多数或所有冠状病毒株的能力。
最近的工作表明SARS-CoV-2有不同的亚型(L和S),6个crRNA(PAC-MAN-T6)包括crRNA-N18f,已被验证能够靶向1,087个SARS-CoV-2基因组中的1,083个(99.6%),只有四个SARS-CoV-2序列携带≥1个错配(图5C),表明该方法可以稳健地靶向不同类型的SARS-CoV-2。总体而言,PAC-MAN-T6可以针对所有已知的人类冠状病毒,并广泛覆盖其他动物冠状病毒。

图5. 使用最少的PAC-MAN crRNA靶向泛冠状病毒
CRISPR-Cas13是一种强大的抗病毒系统,能够使用序列特异性crRNAs保护宿主细菌细胞免受噬菌体感染。在这里,通过PAC-MAN策略,将Cas13d在人细胞中的RNA指导的RNA内切核酸酶活性重新用于病毒靶标SARS-CoV-2和IAV。证明了Cas13d系统可以有效地靶向和切割SARS-CoV-2片段和IAV的RNA序列,并通过适当设计的crRNA在肺上皮细胞中进行切割。此外,生物信息学分析表明,最少的六种crRNA能够靶向91,600个IAV病毒的92%,而六种crRNA能够靶向3,051测序的冠状病毒的91%。这将CRISPR-Cas13系统的应用扩展到了诊断程序之外,例如SHERLOCK和活细胞RNA成像。
值得注意的是,PAC-MAN目前是一种概念验证的抗病毒策略,利用Cas13可以稳健而广泛地靶向保守性病毒序列,在可能治疗COVID-19的临床试验中进行测试之前,还需要采取一些重要的试验。首先是验证crRNA抑制呼吸道细胞受到SARS-CoV-2病毒感染的效率和特异性。当验证PAC-MAN系统可作为病毒感染前的一种预防系统时,证明PAC-MAN也可以用来减少感染后的病毒载量的假设也很重要。
在未来的测试中,这种crRNA选择策略可能与最近发表的预测crRNA效率的算法相结合,以便进一步简化crRNA验证过程。被选择用于治疗性测试的crRNA将需要在实验中评估脱靶效应,比如使用全转录组RNA测序进行评估。此外,虽然他们证实PAC-MAN系统能够在体外抑制病毒序列,但是在治疗上的使用将需要一种有效的体内递送方法将它导入到人呼吸道细胞中。最后,PAC-MAN还需要在相关的临床前模型中进行验证,如雪貂或恒河猴或原代人肺/气道类器官,以测试它的抗病毒疗效和特异性。动物模型也将提供与Cas13d诱导的免疫原性相关的信息,这也是CRISPR-Cas9研究中出现的一个问题。包括开展临床试验在内的这些步骤可能需要几年的时间;虽然PAC-MAN无法阻止目前不断上升的COVID-19病例和相关死亡,但它有可能被用于对抗未来的病毒威胁。
此外,Cas13d能够从crRNA阵列中处理它自己的crRNA的能力意味着多个靶向不同区域的crRNA可以被同时递送,这会进一步降低了病毒逃逸的机会。作为进一步的优势,他们展示了一种潜在的泛冠状病毒策略,它不仅靶向在人类中传播的病毒,而且还靶向那些在动物病毒库中发现的病毒。如果能在这些病毒感染人类之前,对靶向它们的crRNA进行测试和验证,那么人们就能极大地加快开发出应对未来突发威胁的对策。
总之,PAC-MAN策略代表了一种潜在强大地抑制病毒功能和病毒复制的新方法,这些研究人员们设想它可能被用于靶向一系列正在传播的和新出现的病毒威胁。
Abbott T R , Dhamdhere G , Liu Y , et al. Development of CRISPR as an Antiviral Strategy to Combat SARS-CoV-2 and Influenza[J]. Cell, 2020, 181(4).

亓磊教授致力于开发发现式合成生物学以及基因和细胞疗法的技术,将CRISPR基因组工程,分子工程,合成生物学和生物信息学相结合,以研究人类基因组学,并开发出新颖的基因和细胞疗法来治疗癌症,退行性和传染性疾病。

