ANGEW CHEM | 细胞内熵驱动的多比特DNA计算用于肿瘤进展识别
作者:马倩
本文通讯作者是来自西安交通大学生命科学与技术学院的赵永席教授,其课题组研究方向为高通量单分子与单细胞分析、核酸化学与生物学、功能纳米材料与分子探针等。
肿瘤进展(如转移)是涉及不同miRNAs和酶的异常表达的复杂事件。用DNA计算等DNA纳米技术监测活细胞中的这些生物分子可以通过数字输出来区分肿瘤的阶段。在此,作者开发了细胞内熵驱动的多价DNA电路的方法,该方法可实现多位计算,以同时分析细胞内端粒酶和包括miR-21和miR-31在内的microRNAs。这三个生物分子可以触发各自的DNA链置换循环反应,并进行信号放大。通过荧光成像将其可视化,并将其信号输出为针对不同细胞类型的多位二进制代码。实验结果可以区分非致瘤性,恶性和转移性乳腺癌细胞以及各自的肿瘤。该DNA计算电路进一步应用于微流控芯片中,以区分罕见的共培养细胞,为临床样本的分析提供了可能。
在活细胞中,RNA表达和酶活性水平是动态的,在不同的细胞类型和状态下,它们可能有很大的差异。在许多人类疾病中都发现了异常的基因表达。例如,非编码的miR-21,在许多癌症中高表达;而miR-31在正常乳腺细胞中过表达。端粒酶的活性在许多癌症中都增强。因此,在活细胞中同时监测这些生物分子能够区分细胞类型或状态,甚至肿瘤的阶段,用于生物医学和临床研究。DNA纳米技术可以进行程序化计算,可在细胞环境中响应并处理分子信息。许多DNA纳米系统可进入哺乳动物细胞对RNA或酶进行成像,例如DNA四面体纳米镊子可以监控肿瘤相关RNA。也有响应特殊miRNA的DNA逻辑运算。作者在本文中报道了活细胞中熵驱动的多价DNA回路实现多比特的计算以区分细胞种类及肿瘤进程。

Scheme 1. 细胞内熵驱动的多比特DNA计算的原理图描述,用于区分细胞类型和肿瘤进展。(A)活细胞中多价DNA回路的详细DNA回收过程。(B)单细胞成像后的多比特计算。(C)用这种多价电路在小型化芯片中鉴别共培养的细胞样本。
作者首先设计了单价的回路实现或门运算,也设计了可以输出2比特信号的双价逻辑回路,可以分别响应两种生物标志物。接着作者设计了多价的DNA回路,响应两种miRNA(miR-21与miR-31)和端粒酶。该系统由多臂底物探针(SP),端粒酶识别(TR)引物,三种扩增探针(AMPs)构成。这些物质被同时送入细胞后,TR被端粒酶延展,产生酶催化产物(ECP),ECP与miRNA可以通过toehold取代引发SP的解构,与AMPs作用产生荧光信号。整个组装体表现出Y或T型的多臂交联结构,进行2‘邻甲基化修饰后能更加抵抗细胞内核酸酶的降解,这种设计能尽可能地降低背景荧光信号。作者使用不同乳腺细胞进行测试,发现恶性非侵入性细胞MCF-7与SK-BR-3和转移性的MDA-MB-231内miR-21与端粒酶表达水平较高。非肿瘤细胞MCF-10A中miR-31的表达量最高,而在MCF-7与SK-BR-3中miR-31表达水平急剧下降,MDA-MB-231中几乎不表达miR-31。使用这三个维度能很好区分这些不同肿瘤进程中的细胞,因此作者使用0和1来分别表示接近背景的信号与显著增高的信号,考虑到miR-31在不同细胞中表达量不同,为了更好的区分效果,使用00,01与10分别代表低、中、高三种水平,最终形成4比特的密码,可用来区分非肿瘤、恶性与转移性的乳腺细胞系。接着作者又设计了四价的DNA回路系统,可进一步响应miR-132以研究结直肠HCT116细胞。这说明选择合适的生物标志物,可通过类似的方法进行其它细胞的区分。作者最后在微型芯片上完成了对混合培养的乳腺细胞的分类与识别。具体实验过程如下:
设计一价和二价DNA电路
作者首先设计并研究了一价和二价电路(图1A)。各自的AMP序列由两部分组成,每一部分都与P1或P2探针相同。SP反应物和AMP-SP (AS)产物的总碱基对数不变。因此,这个反应是由熵的增加而不是由碱基对或氢键的增加(例如焓的增加)所驱动的。端粒酶ECP和miR-21被用作这两种设计的分子靶点。人类端粒酶催化端粒延长将重复的5'- TTAGGG-3 ' DNA片段添加到端粒区域的3'端。设计单价电路进行OR逻辑运算(图1A上),同时使用二价电路同时分析两个具有2位二进制输出的生物标志物(图1A下)。二价的还可以执行逻辑操作,只需要稍微改变荧光分子和猝灭分子。“Y”或“N”分别被定义为目标的存在或不存在。输出0或1表示背景或高荧光信号。阈值(图1A中的红色虚线)是通过使用最大背景响应的平均值加上其标准差的十倍来粗略确定的。这些DNA回路的信号放大表现为单核苷酸特异性和亚纳米级灵敏度(图1B)。这些优异的性能使我们能够在复杂的细胞内环境中进行相应的检测(图1C)。可以看出,放大后的成像信号高于非AMP样品。
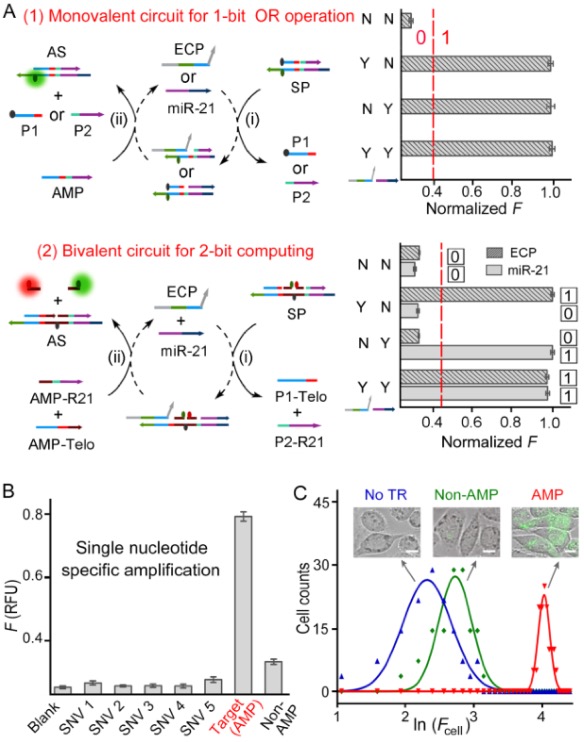
图1. 一价和二价DNA电路的性能测试。(A) 上端: 用于OR逻辑运算的单价电路; 底部:用于2位计算的二价电路。(B)具有单核苷酸特异性的DNA信号扩增。SNV 1-5表示具有单核苷酸变异的输入序列到目标输入。(C)活细胞中这些生物分子的放大显示。Fcell表示单个细胞的荧光强度。insets代表细胞图像。
肿瘤进展的多比特计算多价DNA电路的识别
随后构建了多价DNA电路来探索多比特计算。利用两个miRNAs (miR-21和miR-31) 和端粒酶设计三价DNA循环系统。通过低温电子显微镜(cryo-EM)和凝胶电泳(图2A)对其预组装的SP进行分析。图2A显示了约20nm的Y形或T形多臂结结构。除了2’-邻甲基修饰外,这种纳米结构的SP可能进一步抵抗活细胞中的核酸酶降解。这样的设计也可以抑制背景荧光信号。通过荧光图像和光谱分析证实了该多臂SP的成功组装和拆卸(图2B)。
接着在不同类型的乳腺细胞系中研究电路在活细胞中的性能。其中包括非致瘤性MCF-10A、恶性(非侵袭性)MCF-7或SK-BR-3,以及转移性(高度侵袭性)MDA-MB-231。如图2C、2D所示,恶性细胞和转移性MDA-MB-231中miR-21和端粒酶活性表达水平较高,而MCF-10A中miR-31的表达水平最高。在MCF-7和SK-BR-3中,miR-31的表达水平显著下降,而在MDAMB-231中,miR-31的表达水平几乎可以忽略不计。这一发现与miR-31在乳腺癌进展中的抗转移作用一致。该电路使用了三个荧光通道,分析了不同的细胞株。接近背景值的单细胞信号被认为是二进制0输出,其他明显高值的信号都被认为是1。阈值是根据1个样本的最小值与0个样本的最大值之间的差距粗略确定的。最后,得到了表示这些单元类型的3位二进制代码。然而,每个bit或荧光通道的1个输出覆盖了不止一种类型的细胞样本。

图2。用于区分肿瘤细胞类型的三价DNA电路。(A)低温电子显微镜(左图)和凝胶电泳(右图)对纳米SPs组装的表征。(B) SPs的组装(插图左,共聚焦曲线)和拆卸(插图右,电路时间曲线)的共聚焦显微镜分析。(C)三价DNA循环系统检测不同乳腺细胞系的代表性细胞图像。(D)用独特的3位二进制编码表示的这些细胞系中三个通道的单细胞荧光强度(Fcell)的比较。紫色、红色和绿色的信号分别代表miR-31、miR-21和端粒酶。
虽然通过联合端粒酶和miR-21分析,MCF-7(或SK-BR-3)和MDA-MB-231分化较差,但通过三维可视化显示,它们与MCF-10A一起在特定区域占主导地位(图3A)。另外,MCF-7和SK-BR-3两种非侵袭性恶性细胞信号范围相似。miR-31、MDA-MB-231的维度由于信号可以忽略而可以编码为0,而MCF-7(或SK-BR-3)和MCF- 10A在信号较高时编码为1。为了更好地识别(图3B),作者将荧光值在0-10、19-63和45-110附近的miR-31信号值分别定义为00、01和10个状态。因此,这个1位二进制代码被解释为一个2位二进制代码。结合端粒酶信号和miR-21信号编码,这些细胞类型由一系列4位二进制编码表示(图3B)。结果能够区分非致瘤性、恶性和转移性的乳腺细胞系。此外,各荷瘤小鼠的分析结果也一致(图3C)。

图3。三维可视化和多位计算。(A)图2D中所示的基于miR-31信号、端粒酶信号和miR-21信号参数的单细胞分布散点图。(B) 利用上述三个参数进行多比特计算,以区分这些单元类型。括号中的数据是Fcell的信号值。(C)荷瘤小鼠相应的体内分析结果。将MDA-MB-231、MCF-7和MCF- 10A分别注射到三只小鼠(左至右)体内。
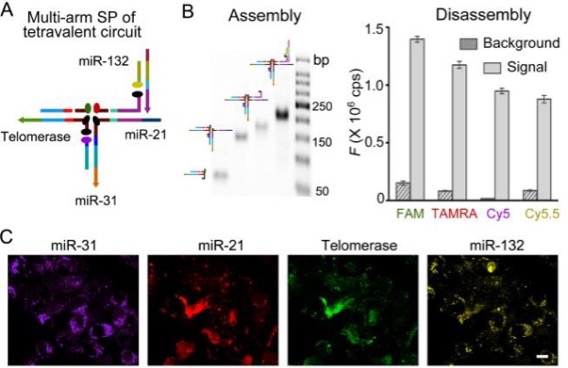
图4。针对端粒酶和三个miRNA的四价DNA回路的设计和性能测试。(A)多臂接点结构的SP综合设计图。(B)通过凝胶电泳和荧光光谱分析SPs的组装和目标触发的解组装。(C)用该DNA循环系统处理的细胞样本的代表性细胞图像。
为了进一步证明该DNA电路系统的可扩展性,作者设计了一个四价电路。它结合了三价电路与另一个miRNA触发电路。如图4所示,新的SP复合体仍然使用多臂结进行设计。通过凝胶电泳和荧光光谱对其组装和拆卸进行了验证。在结直肠HCT116细胞系中,研究了这一四价电路在活细胞中的应用,以响应miR-132的表达。通过活细胞成像观察到四种不同的荧光信号(图4C),证实了该四价回路在细胞内的实用性。在前人研究的基础上,选择合适的分子标志物组合,可以用所提出的方法对相关的结直肠或其他细胞样本进行鉴别。除了端粒酶外,其他内源酶如DNA糖化酶也可以通过该方法和对应的识别探针进行分析。此外,通过遵循这一规则来设计多臂结构,可以很容易地开发出高价电路。原则上,同时监测更多的生物标志物可以提供更高维度的信息,以便更准确的诊断和更广泛的应用。
罕见肿瘤细胞的芯片识别
最后,该工作实现了三价DNA电路在一个小型化芯片上分析罕见细胞。首次对共培养样品中细胞系的鉴定进行了研究。不同的乳腺细胞系在同一芯片腔内共培养。按照多比特二进制码进行描述然后评估细胞对化学药物的反应。他莫西芬(TAM)是一种著名的雌激素受体(ER)拮抗剂,用于治疗乳腺癌。作者在经TAM处理的MCF-7样品中观察到细胞碎片(白色箭头所示)(图5的图像IV),这表明TAM对ER-阳性 MCF-7的生长有抑制作用。但是,当MCF-7与ER-阴性的MDA-MB-231共培养时,得到了相反的结果(图5的图像V)。可以观察到,即使使用TAM治疗,MCF-7细胞也有显著增长。这说明MDA-MB-231可能会干扰TAM对复杂肿瘤微环境中ER-阳性细胞生长的抑制作用。除了培养的细胞外,该方法还可以分析细针穿刺活检或组织切片获得的临床细胞样本,使用专门的微流体芯片进行必要的细胞操作,具有评估真实样本的潜力。
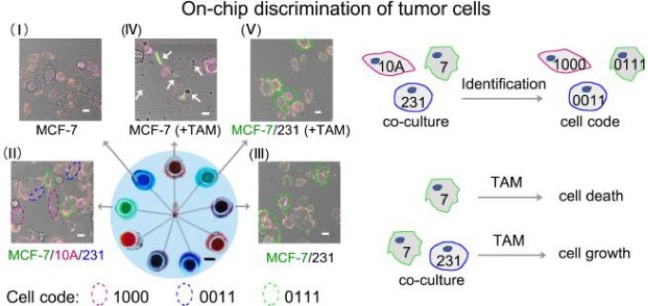
图5。利用三价DNA循环系统在微型化芯片(标尺为2mm)中鉴别罕见肿瘤细胞。符号(+TAM)表示用TAM处理细胞。图IV中的白色箭头表示细胞碎片。这里使用了图3中的单元代码。在image III和V中,未标记的单元格为MDA-MB-231。右图显示左图的结果。
综上所述,作者开发了live-vell熵驱动的多价DNA电路作为计算设备,用于同时监测单个细胞中的两个miRNAs和端粒酶。这些生物分子通过各自的DNA链置换循环反应来放大荧光信号。揭示了不同乳腺细胞系miRNA表达水平和端粒酶活性的差异。它们的成像信号一起被编码为不同类型细胞的多比特二进制代码。作者首次证明它们可以用来区分非致瘤性、恶性和转移性乳腺细胞以及各自的肿瘤。该模块化的电路系统易于扩展到更高的多路复用。最后,在一个小型芯片中实现了一个多价电路,用于分析罕见的共培养细胞,在临床分析中具有潜在的应用。
文章链接:
https://www.onlinelibrary.wiley.com/doi/10.1002/ange.202001598
文章引用:DOI:10.1002/anie.202001598

