NAT COMMUN丨基于核酸适体的光学操控蛋白质的亚细胞定位
作者:高倩倩
精确的控制蛋白质活性及其在活细胞内的位置,可以促进全面了解活细胞内一些以蛋白质为主的过程。光遗传学的发展使得以分子特异性控制细胞蛋白时空变化成为可能。然而,这些方法依赖于融合蛋白的重组表达,导致结果冲突的情况时有发生。
中国科学院院士谭蔚泓课题组在国际学术期刊Nature communication上发表论文Aptamer-based optical manipulation of protein subcellular localization in cells.,开发了一种基于核酸适体的近红外(NIR)光响应性纳米平台,用于操纵天然状态下靶蛋白的亚细胞定位。在这项工作中,作者没有致力于修饰目标蛋白,而是着眼于设计一种可调节的识别单元。研究结果表明,这种纳米平台可以对目标RelA蛋白(NF-κβ家族成员)的细胞质-核穿梭行为进行光控,从而可以调节RelA相关的信号通路。通过模块化设计,这种基于核酸适体的纳米平台可以拓展应用于操纵其他蛋白质(例如溶菌酶和p53),具有发展多种无标记蛋白光调节策略来研究复杂生物过程巨大潜力。
图文解读
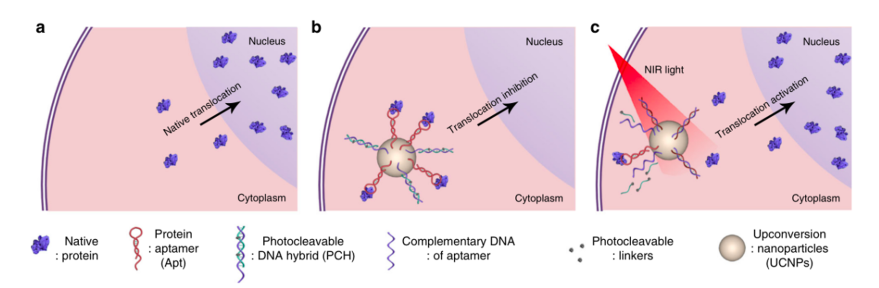
图1 基于核酸适体的近红外响应纳米平台,用于操纵活细胞中天然蛋白的亚细胞定位示意图。a. 蛋白质从细胞质到细胞核的转运行为 b. 蛋白特异性核酸适体(Apt)和可光裂解的DNA杂合体(PCH2)被功能化连接到UCNPs表面。内化进入细胞之后,PCH2-Apt-UCNPs可以特异性捕获靶蛋白并抑制其亚细胞运输行为。c. UCNPs可将近红外光激发转化为紫外光,在紫外光作用下,PCH2被激活从而从Apt/蛋白质结合复合物中竞争结合Apt,进而释放蛋白质以恢复其天然生物功能。
作者首先构建了基于核酸适体的光响应性纳米平台。设计的要点主要有:1、cDNA / bDNA杂交体应足够稳定,以最大程度地降低cDNA对Apt与靶蛋白结合效率的干扰;2、在光激活后,应迅速释放cDNA,使其与靶蛋白/ Apt复合物竞争结合Apt,从而有效释放靶蛋白以恢复其天然功能。

图2.基于核酸适体的光响应纳米平台的设计和表征 a.在UV光照射下Cy5标记的Apt和Cy3标记的PCH 2之间的链置换反应的示意图 b. 在插入不同PC linker(PCH 0,PCH 1和PCH 2)情况下,Cy3和Cy5之间的共振能量转移(FRET)信号的动力学分析 c. UCNP核心,UCNP和PCH2 -Apt-UCNP的动态光散射光谱。 插图:UCNP核心的TEM图像 d. UCNP,PCH2 -Apt-UCNP和PCH2 -Apt-UCNP(Cy3 / 5)(含有Cy5标记的Apt和Cy3标记的PCH2的PCH 2 -Apt-UCNP)的紫外线吸收谱e. 980nm激发下UCNPs和PCH2 -Apt-UCNPs(Cy3 / 5)的发光光谱f. PCH2 -Apt-UCNPs的近红外响应杂交开关的示意图g. PCH2 -Apt-UCNPs的FRET信号的动力学分析。
随后,作者对该光响应性平台能否精确控制RelA蛋白的行为进行了研究,作者以肺癌细胞系A549为细胞模型,将A549细胞与PCH2-Apt-UCNP共孵育,通过共聚焦激光扫描显微镜从Apt的Cy5信号监测其细胞摄取和细胞内分布情况,证明PCH2 -Apt-UCNPs可以被内化到细胞质(图3)。
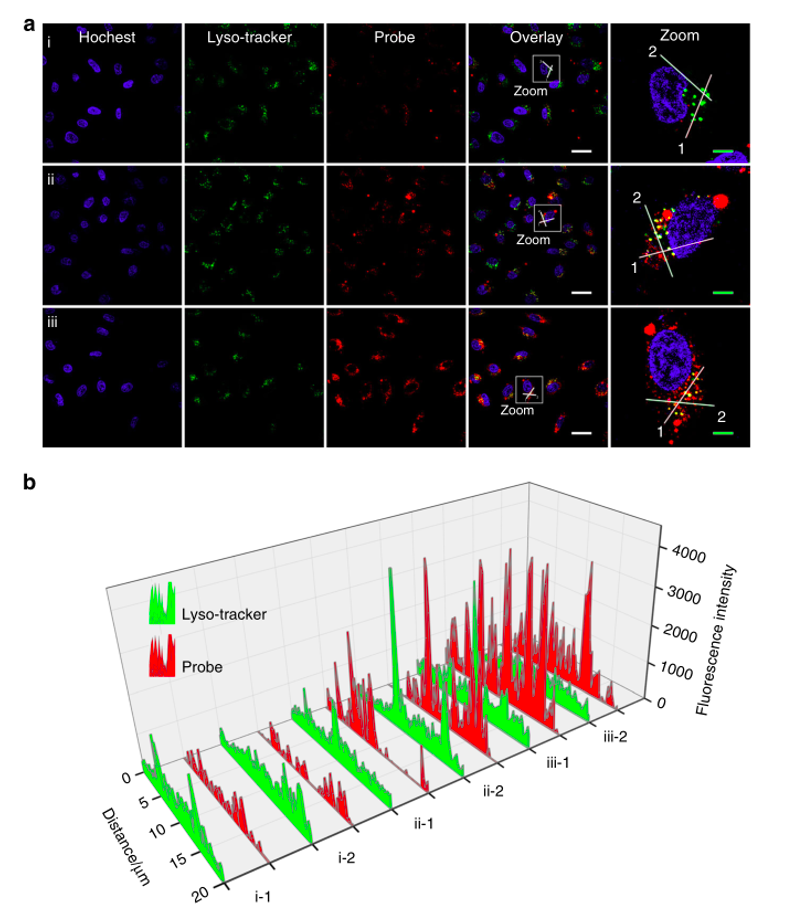
图3 PCH2 -Apt-UCNPs的时间依赖性细胞摄取和细胞内分布。 用PCH2 -Apt-UCNP处理2小时(i),4小时(ii)和6小时(iii)的活A549细胞的CLSM成像。b缩放图像中线性区域(i-1,2,ii-1,2和iii-1,2)的Cy5荧光强度分析。 用Cy5荧光信号追踪PCH2 -Apt-UCNP ,细胞核和溶酶体分别用Hoechst 33258(蓝色)和LysoTracker绿色(绿色)染色。 重叠图像和缩放图像中的比例尺分别表示30μm和6μm。
作者通过使用Image J软件的荧光强度计算证实RelA细胞分布的改变源自UCNP核心周围的适体特异性RelA自组装。并根据CLSM数据的荧光强度变化,证明使用NIR激光辐照可以有效地操控天然RelA蛋白的亚细胞运输行为。随后设置对照组,将PCH2 -Apt-UCNPs中的cDNA替换为不能与适体杂交的链,发现即使用NIR辐照,该对照纳米颗粒还是无法介导RelA的核易位,证明RelA蛋白质调控起源来自核酸适体的构象开关。
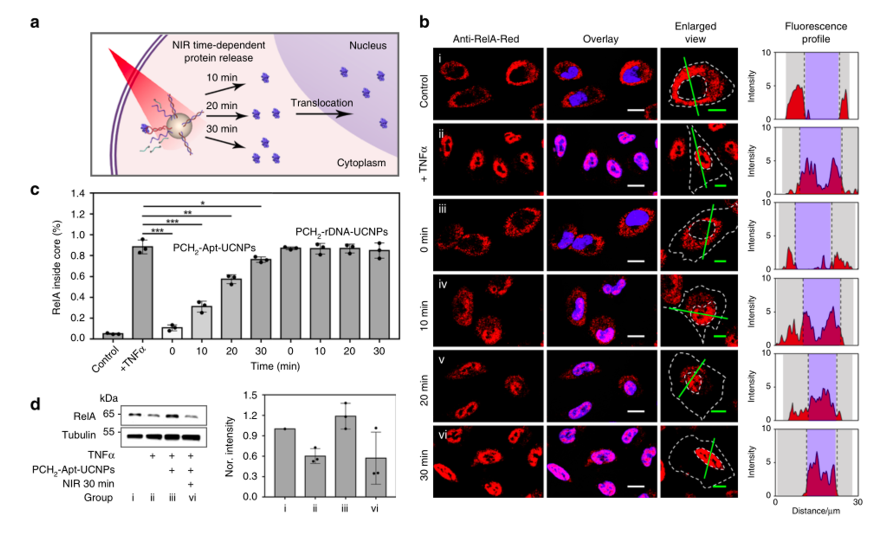
图4 NIR光辐射控制天然RelA在活细胞内定位a.RelA的依赖NIR的核转运的示意图。b.对A549细胞进行不同处理的CLSM成像:未处理的对照(i),TNFα刺激(ii),PCH 2 -Apt-UCNPs预处理,然后进行NIR激光照射0min(iii),10min(iv),20min(v)和30分钟(vi)分钟,以及TNFα刺激。从左至右:PE-抗RelA的荧光通道,PE荧光通道的放大图以及直线绿线的PE荧光分布图(紫色域表示核区域;灰色域表示胞质区域)。重叠图像和放大视图图像中的比例尺分别代表15μm和10μm。 c经过不同处理后,PE-抗RelA在A549细胞核中的相对荧光强度。为了进行统计分析,从三张CLSM图像中获取数据,并针对每种情况使用Image J软件进行分析。d不同处理后A549细胞胞质中天然RelA的Western印迹分析:未处理的对照(i),TNFα刺激(ii)和PCH 2 -Apt-UCNPs预处理,然后在NIR激光照射0min后刺激TNFα或30分钟(vi)。
为了测试这种基于核酸适体的光响应纳米平台对蛋白质调节的普遍性,作者设计了另一种蛋白p53/适体展示系统,发现该纳米平台有在复杂生物系统中光控调节不同蛋白的潜力,并且易位模式超越了细胞质到细胞核的转移。
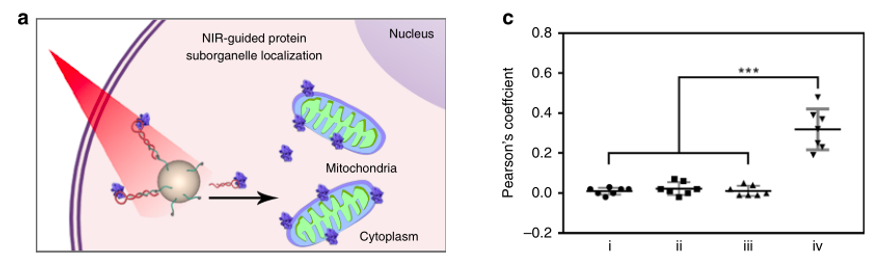
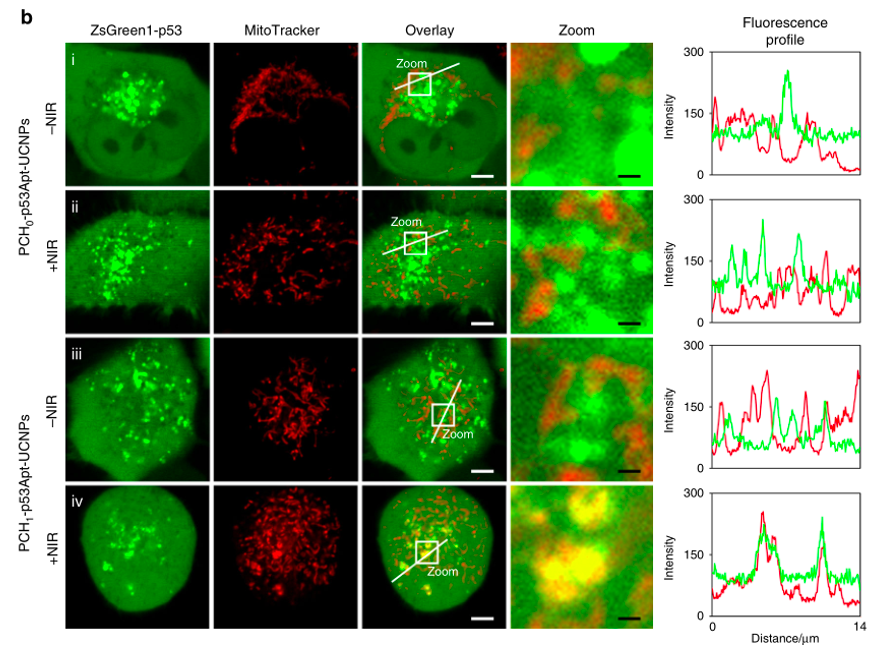
总之,作者开发了一种基于核酸适体的NIR光响应纳米平台,与传统策略不同,此设计不需要对目标蛋白进行化学或遗传学修饰,可以通过近红外光精确控制蛋白的亚细胞转运行为,从而可以调节活细胞中靶蛋白相关的信号通路。
Xie S, Du Y, Zhang Y, Wang Z, Zhang D, He L, Qiu L, Jiang J, Tan W. Aptamer-based optical manipulation of protein subcellular localization in cells. Nat Commun. 2020 Mar 12;11(1):1347. doi: 10.1038/s41467-020-15113-2.

