NAT COMMUN丨分形DNA框架编码量化的荧光状态
作者:杨林林
人工荧光放大器的多路复用能力通常受到尺寸和缺乏模块化的限制。本文作者开发了“Cayley tree”状分形DNA框架(FDFs),在最小限度地使用DNA链的情况下打破大小限制,并提高复用的模块性。作者使用四面体(TDNs)作为节点自组装生成刚柔兼备的FDFs,其分子量可达5 MD。利用自相似的拓扑结构(节点连接排列),构建的FDF放大器仅包含16条DNA链,却可编码多达36种颜色,且串扰最小。这些FDFs可对定量荧光状态进行拓扑编码,用于单分子识别和多路细胞识别。
分形DNA框架(FDFs)的构建如图1a所示,“Cayley tree”状FDF(Fn,i,其中n为各节点的配位数,i为结构的迭代数)由TDNs作为节点组装形成,AFM图中FDFs包含TDNs的数量与预期一致,说明用TDNs的配位数和迭代数定义的精确节点数能够确定FDFs的形成。值得注意的是仅使用16条DNA链即可形成包含53个TDNs,分子量~5 MD的FDF(F4,3),FDFs的自相似性有助于在最少使用DNA链的情况下制备超大尺寸的DNA纳米材料。
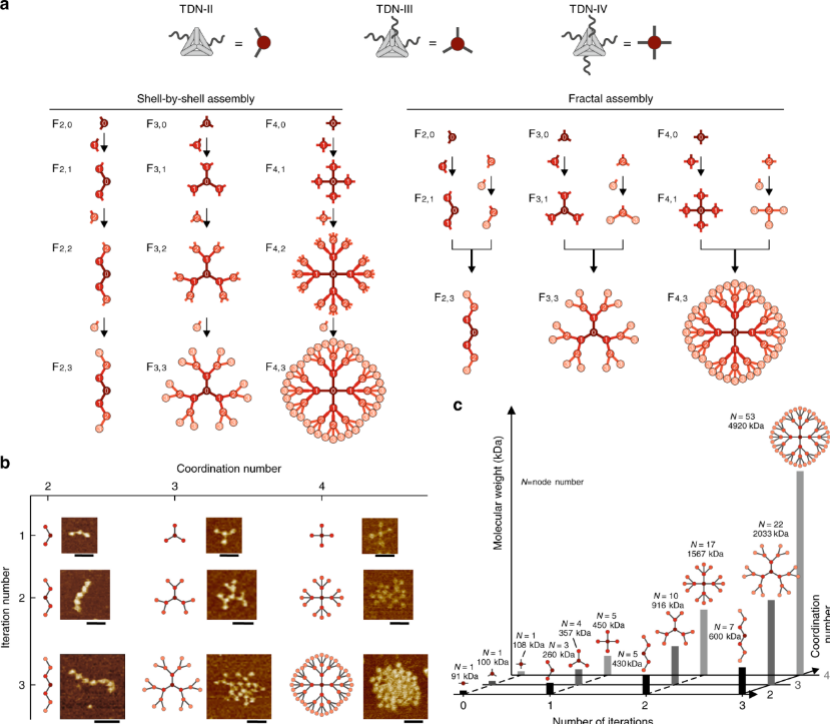
图1. 具有精确节点数和分子量的分形DNA框架(FDFs)。a FDFs的组装示意图。b FDFs的AFM图。c具有不同节点数(N)的FDFs的分子量。
接下来作者研究了FDF的结构性质(图2),在不同的FDFs中,TDNs尺寸均匀,与单体TDNs一致,说明TDNs在FDFs中保持结构完整和一定的刚性。然而,F2,3结构呈弯曲构象,且其节点间角度分布较广(从50到180),说明尽管节点是刚性的,F2,3这一类结构仍具有较高的柔性,这一特性允许构建刚柔兼备的DNA材料。此外,F4,3的花状高斯散斑表明溶液中F4,3结构的近球形形貌,根节点的荧光位置与斑点的几何中心存在一定程度的偏离,说明F4,3结构具有一定的柔性。然后考察了FDF结构的刚性是否可以通过拓扑工程进行调整。F2,2和F4,1具有相同的节点数和不同的拓扑结构,AFM显示F2,2结构与F4,1相比存在较大的尺寸偏差,表明F4,1结构相对紧凑和刚性,而F2,2的结构比较松散和灵活,这种差异可归因于其组装TDNs的不同拓扑。
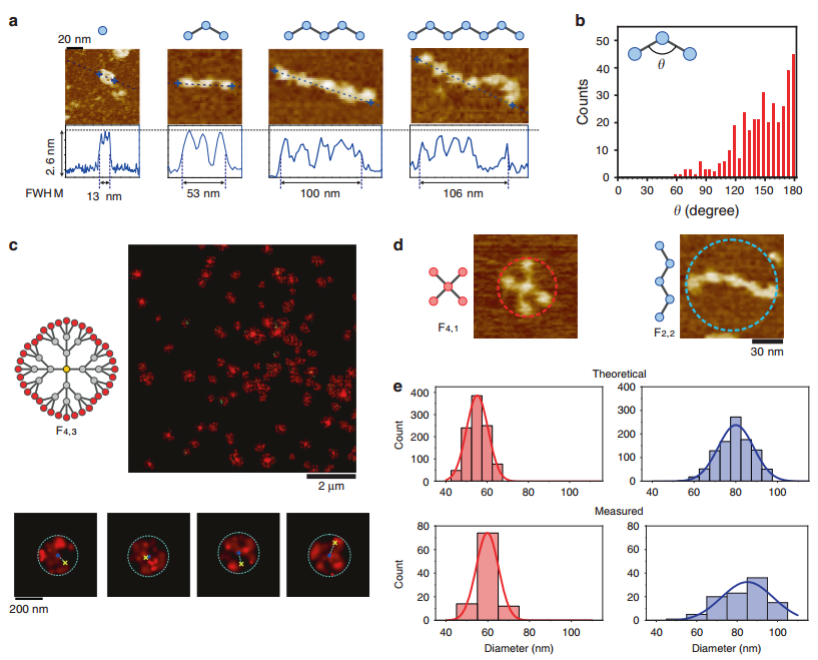
图2拓扑工程结构紧凑的FDFs。a F2,i (i = 0-3)的AFM图。b F2,i节点间角度的直方图统计。c F4,3的结构示意图及其随机光学重建显微镜(STORM)图像。红色散斑,外壳TDNs(Alexa647)。黄色十字,the root TDN (Cy3)。蓝点,圆的几何中心。D F4,1和F2,2的AFM代表性图像。e F4,1和F2,2理论模拟(N = 1000)和AFM测量(N = 100) 的直径分布。
作者利用该刚柔兼备的FDFs,测试了荧光分子是否可以在这些支架上精确地组装,产生量化的荧光,同时产生最小的串扰(图3)。通过在F2,3结构上锚定3个Cy3和4个Cy5(每个节点1个荧光分子)进行FRET分析,发现其荧光光谱与[TDN-Cy5]3和[TDNCy3]4的简单混合物相似,说明F2,3结构上Cy3-Cy5之间的距离超出了有效的FRET距离(> 10 nm)。接下来,作者在F2,3结构的每个TDN节点上规定了四个锚定位点,通过将4-28个Alexa488分子锚定在F2,3上,发现其荧光强度增加与A488数目呈线性,使FDF成为一种定量放大器用于高亮度荧光成像。通过将三种不同发射波长的荧光分子(Cy5, 668 nm; ROX, 606 nm; A488, 517 nm)锚定在FDFs上,进一步评估了FDF结构中不同荧光分子之间的荧光串扰。不管是否存在其他类型的荧光分子,每个颜色通道的荧光强度与相应荧光分子的数量成正比,证实了FDFs使荧光分子的空间分离成为可能。由于节点组合的多样性,FDFs具有较高的数据容量,F2,3的共焦荧光图像显示了一个包含36种伪色的调色板,这些颜色超出了荧光成像的传统多路复用限制(通常为4 - 5种颜色)。
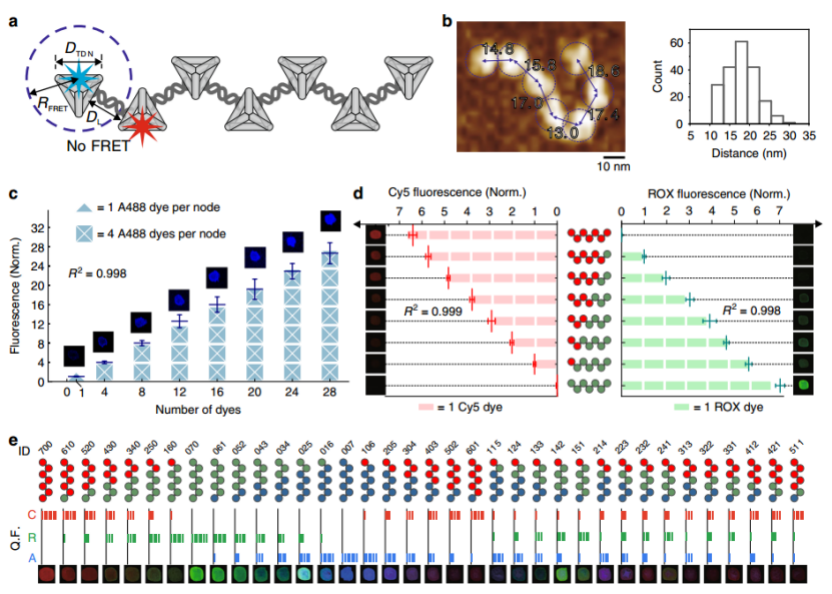
图3. FDFs编码量化的荧光状态。a FDF结构与空间控制的荧光分子的示意图。b F2,3结构的AFM图及F2,n结构节点间距离的统计分布。c F2,3结构的荧光强度与A488数目的相关性。d 荧光强度与锚定在F2,3结构上的ROX和Cy5数目的相关性。e 不同荧光分子组合编码的36种FDF条码,可被荧光光谱/显微镜解码。
接下来,将FDF编码的条形码作为探针应用于单分子识别和成像。这一目标的关键是解码单个条形码分子的荧光信号,即确定特定颜色条形码上荧光分子的数量和类型。鉴于条形码的荧光状态是定量的,在高功率激光下的荧光应该呈现出逐步的光漂白痕迹,如图4a所示。条形码可以通过光漂白痕迹中的步骤数来解码,这些步骤数对应于荧光分子的个数。为了验证这一解码策略,使用全内反射荧光显微镜(TIRF)研究了两种FDF条形码的光漂白痕迹。对于条形码140,可以观察到与一个Cy5相对应的一步下降荧光轨迹(78%)。而对于条码410,我们观察到大多数(59%)的四步光漂白痕迹,表明有四个Cy5存在。使用561纳米激光对ROX进行激发和光漂白(图4c),条形码140(54%)显示四步荧光猝灭痕迹,而条形码410(84%)显示单步荧光猝灭痕迹。这些结果证实了通过光漂白和单粒子荧光跟踪可以在单分子水平上解码定量的FDF条形码。
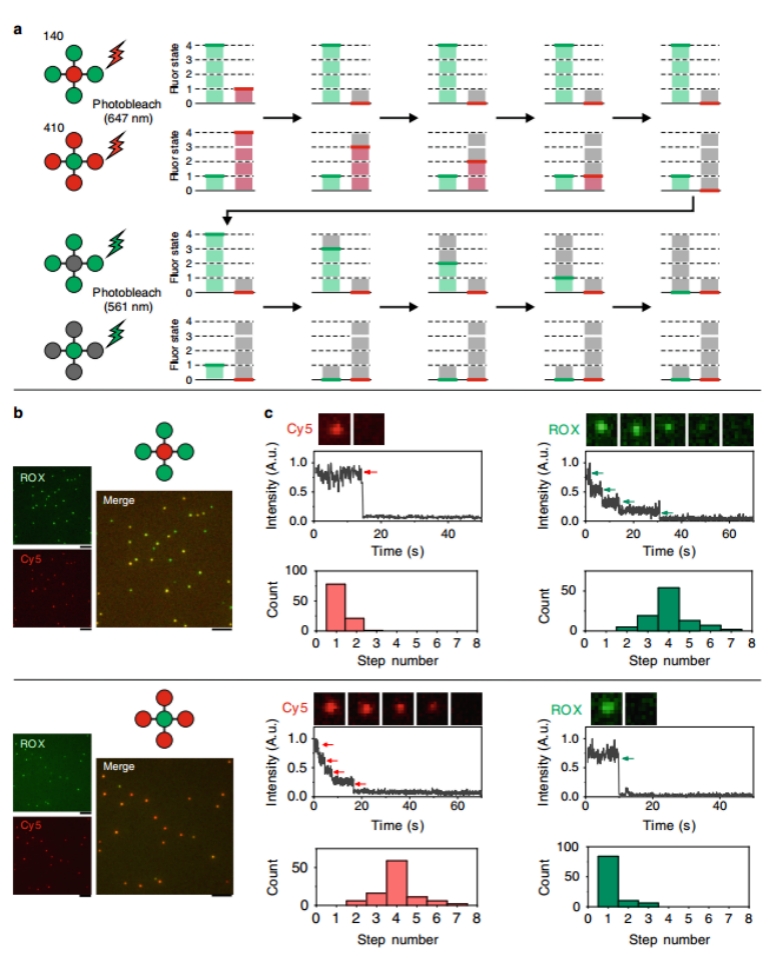
图4. 通过量化的光漂白解码FDF条形码。a 不同FDF条形码的量化光漂白示意图。b FDF条形码的荧光显微图像。c单分子荧光猝灭快照,FDF条形码的动力学,猝灭步骤数分布。
单分子识别实验中,响应特定DNA靶标的FDF探针如图5所示,特定靶标的存在会导致FDF结构中某些TDN节点的量化释放。作者追踪了单分子荧光动力学对靶标输入的响应。加入靶标1后,Cy5的荧光消失,而A488和ROX的阶梯光漂白动力学仍然存在,说明靶标1仅诱导了Cy5-nodes的特异性释放。加入靶标2后,Cy5和ROX的荧光消失,只留下A488呈现一步光漂白动力学,说明靶标2的存在触发了ROX-nodes的释放。使用量化的FDFs可以将靶标诱导的探针裂解转化为可读的量化的单分子水平上的荧光状态变化,并且具有序列敏感性。
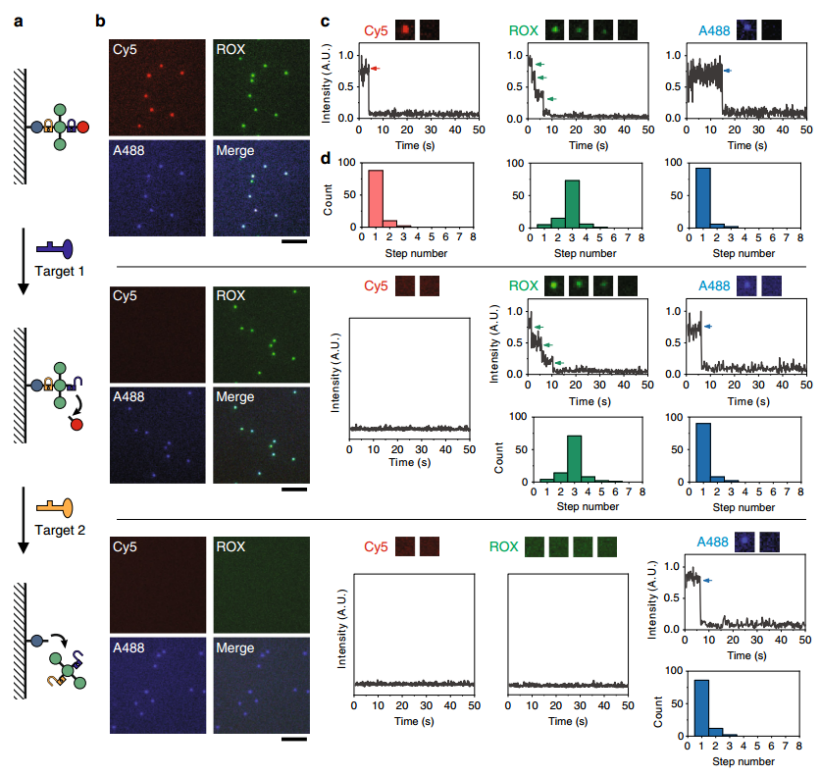
图5. FDF探针的单分子识别。a分子识别策略的示意图。b FDF探针的荧光显微图像。c FDF探针在不同靶标下的单分子荧光猝灭动力学。
构建FDF条形码之后,作者进一步寻求将其应用于多路细胞成像和识别。作者制备了4种基于F4,1的FDF条形码,分别携带四条不同序列的悬臂(图6)。四组HeLa细胞分别标记了胆固醇修饰的ssDNA(chol-DNA),与FDF条形码的悬臂正交互补。然后将细胞与四种FDF条形码混合并孵育。流式细胞结果显示,细胞混合物可以被分为4个不同的A647/A488荧光强度比的分离群体,这4个荧光强度比分别对应于4个FDF条形码,与单独标记细胞的结果一致。在广角荧光图像中,根据细胞的荧光强度分布,也可以将细胞分为4组,与4个FDF条形码相匹配。综上所述,这些结果表明FDF条形码的多样性允许在混合细胞中识别多个细胞群体。
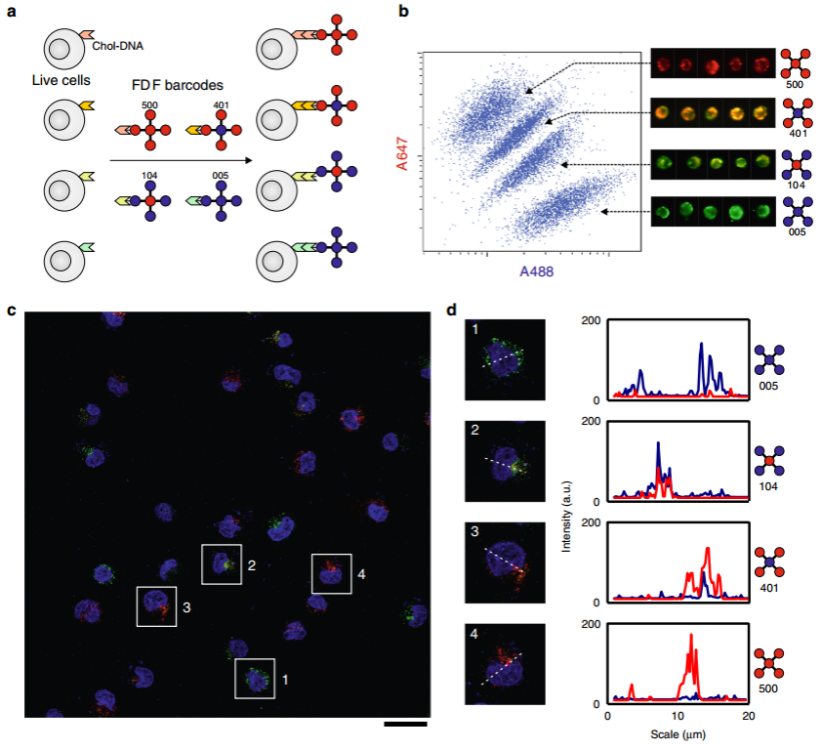
图6. 用于细胞成像和识别的FDF条形码。a FDF条码用于区分细胞群的示意图。b细胞分选过程中FDF标记细胞的流式细胞图和代表性快照。c FDF标记细胞的广角荧光图像和d荧光强度剖面。
本文作者使用四面体作为“Cayley tree”框架的刚性节点,构建了具有固定节点数和客体分子的FDF结构。FDFs的结构灵活性可以通过拓扑工程实现,这使得DNA纳米材料具有可调的力学性能。此外,这些节点具有较大的信息容量和最小的串扰。通过在每个TDN节点上分别锚定不同发射波长的荧光分子,合成了彩色编码的多路复用探针,用于识别不同的分子和活细胞。因此,FDFs为多路复用和定量检测低丰度生物靶标提供了一个高度通用的扩增工具集。
Li, J., Dai, J., Jiang, S. et al. Encoding quantized fluorescence states with fractal DNA frameworks. Nat Commun 11, 2185 (2020). https://doi.org/10.1038/s41467-020-16112-z

