JACS丨一个APN活化的荧光探针跟踪转移癌症和通过原位喷涂成像引导手术
作者:晁丹丹
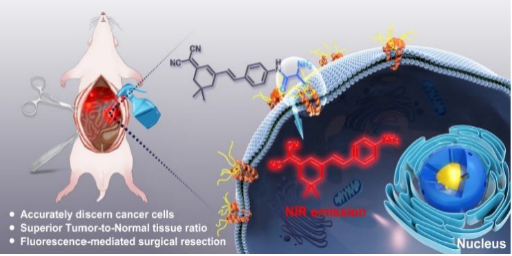
肿瘤的不完全切除通常是造成癌症复发的主要原因。然而对于外科医生来说,由于缺乏准确辨别肿瘤和正常组织的技术手段,想要精确探测及准确移除肿瘤是非常困难的。APN(氨基肽酶)是一种肿瘤特异性酶,作为癌症特异性生物标志物,它介导肿瘤的发展、入侵和转移。基于此,作者引入了一种对APN迅速响应的荧光探针(YH-APN),它的荧光信号可以通过一步酶促反应迅速被激活。由于该探针具有优异的选择性及灵敏度,因此在分辨肿瘤组织与正常组织时,具有卓越的信噪比。通过原位喷涂的方法,能够成像直径范围小于1 mm的转移肿瘤组织,有望用于实时引导肿瘤切除手术。
(1)YH-APN对于APN的响应机制
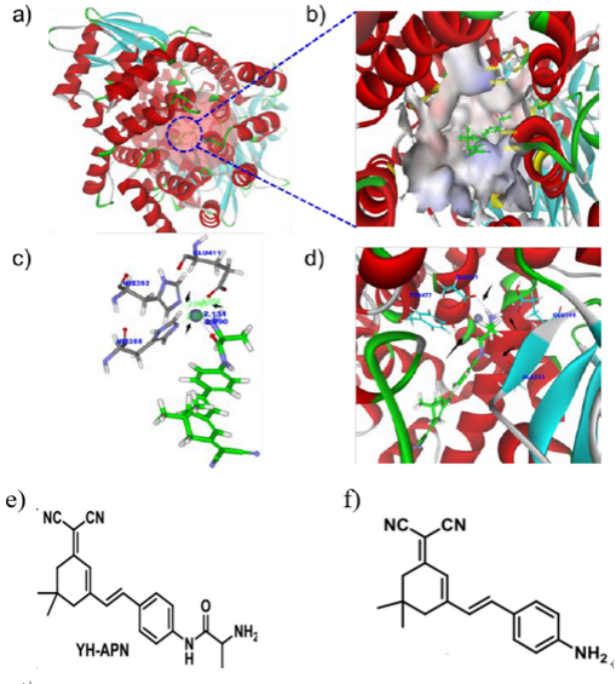
图1. a) 人类APN结合位点(红色透明球体)的立体图像。b) YH-APN通过完全开放的疏水空腔到达Zn2+配位中心。c) YH-APN与APN的配位键键长。 d) YH-APN与APN中氨基酸残基 Tyr477, Glu411, Glu355, Ala353的氢键。
作者以人类APN作为研究模型,通过计算模拟发现,YH-APN由于与酶的疏水空腔匹配,从而倾向于接近Zn2+配位中心,YH-APN与APN的配位键长度非常接近其与氨基酸残基的固有配位键长度。除此之外,YH-APN与APN中氨
基酸残基之间形成的氢键也使其牢牢地锚定在APN的疏水腔中。借助以Zn2+为中心的催化体系作用下,YH-APN中的酰胺键被剪切,转化成f)中的结构,释放出氨基,作为强给电子体,与苯环上的Π键共轭,诱导发出荧光。
(2) HY-APN的光谱特性及对APN的选择性表征

图2. a)荧光光谱滴定实验。 b) YH-APN 在650 nm处的荧光强度与低浓度的APN之间的线性关系。c) YH-APN 在PBS中对APN的选择性。d) Ube对APN活性的抑制特性。
在PBS中,YH-APN对APN的检出限可达0.13 ng/ml,其超高的灵敏度及选择性,使其在检测肿瘤细胞时,具有优异的信噪比。
(3)HY-APN对APN过表达癌细胞的响应速度和选择性荧光成像
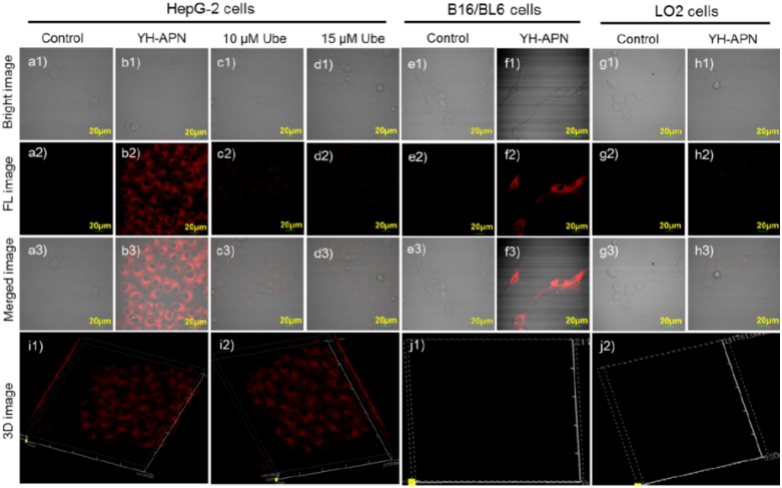
图3. 37 ℃下,将5 μM的 YH-APN分别与HepG-2(肝癌细胞),B16/BL6(小鼠黑色素瘤细胞),LO2(健康人干细胞)细胞共孵育30 min后的荧光图像。a-d)HepG-2 细胞: a1-a3) 对照组; b1-b3) 与5 μM YH-APN共孵育; c1-c3)用 10 μM Ube进行前处理,然后与 5 μM YH-APN共孵育;d1-d3) 用 15 μM Ube进行前处理,然后与 5 μM YH-APN共孵育。 e-f) B16/BL6 细胞: e1-e3) 对照组; f1-f3) 与5 μM YH-APN共孵育。 g-h) LO2 细胞: g1-g3) 对照组; h1-h3) 与5 μM YH-APN共孵育。 i) HepG-2 细胞的三维荧光图像; j) LO2 细胞的三维荧光成像图。
在验证了YH-APN对细胞无毒之后,作者以健康人的肝细胞做阴性对照,利用荧光成像的方式研究了YH-APN对肝癌细胞及小鼠黑色素瘤细胞上APN的相应情况。并揭示了Ube之所以能够抑制响应过程,是因为其占据催化位点,抑制酶水解底物,从而进一步说明过表达的APN对于诱导荧光信号的重要作用

图4. 对YH-APN处理过的混合细胞培养体系进行荧光成像. a1-b10) 对混合培养的HepG-2 (青色区域)及LO2 (绿色区域)细胞进行深度扫描荧光成像。c-h) HepG-2 (青色区域)及Cos7 (绿色区域)细胞的不同通道在Z轴上的灰度投影。(i-k) 混合培养细胞的三维成像。
为了证明YH-APN能够从健康细胞中分理出肿瘤细胞,作者将健康肝细胞分别与肝癌细胞(图4.A)与非洲绿猴肾纤维细胞(图4.B)混合孵育,利用荧光成像证明其这一能力。

图5. 恶性肿瘤细胞的迁移特征。a-i): 用YH-APN 处理过的HepG-2细胞; j-r) 用100 μM Ube 进行预处理,再用YH-APN处理的HepG-2细胞;s) b, d, g, j, m, p图中的迁移距离。
侵染和迁移是恶性肿瘤细胞最基本的特征之一。由于APN介导肿瘤转移,因此作者进行了细胞划痕实验,分别研究了肿瘤细胞以及用Ube处理过的肿瘤细胞的迁移特性,发现Ube处理过的肿瘤细胞迁移速度明显变慢,这是由于Ube限制了APN的活性,进一步说明了利用HY-APN对APN的荧光响应可以跟踪肿瘤细胞的转移。
(4)HY-APN响应内源性APN在组织和体内的成像

图6:对具有HepG-2移植瘤和组织的裸鼠进行内源性APN活性的成像。在小鼠体内注射YH-APN (50 μM, 50 μL),观察荧光信号随时间的变化:a)0 min; b) 20 min; c) 50 min; d) 70 min; e) 100 min; f) 120 min; g) 150 min. k) 随着时间变化,从小鼠肿瘤位置采集的平均荧光强度值。h-j) 肿瘤组织荧光成像; l-n)正常组织荧光成像。o) 肿瘤组织的三维成像。双光子激发:800 nm, 发射波长:575-630 nm。
将HY-APN从雌性小鼠的右侧腋下注射,待肿瘤形成,先对其进行麻醉,而后进行荧光成像观察。在注射HY-APN注射20min后,便会有明显的荧光出现,并可持续150min.
(5)喷涂YH-APN图像指导手术切除
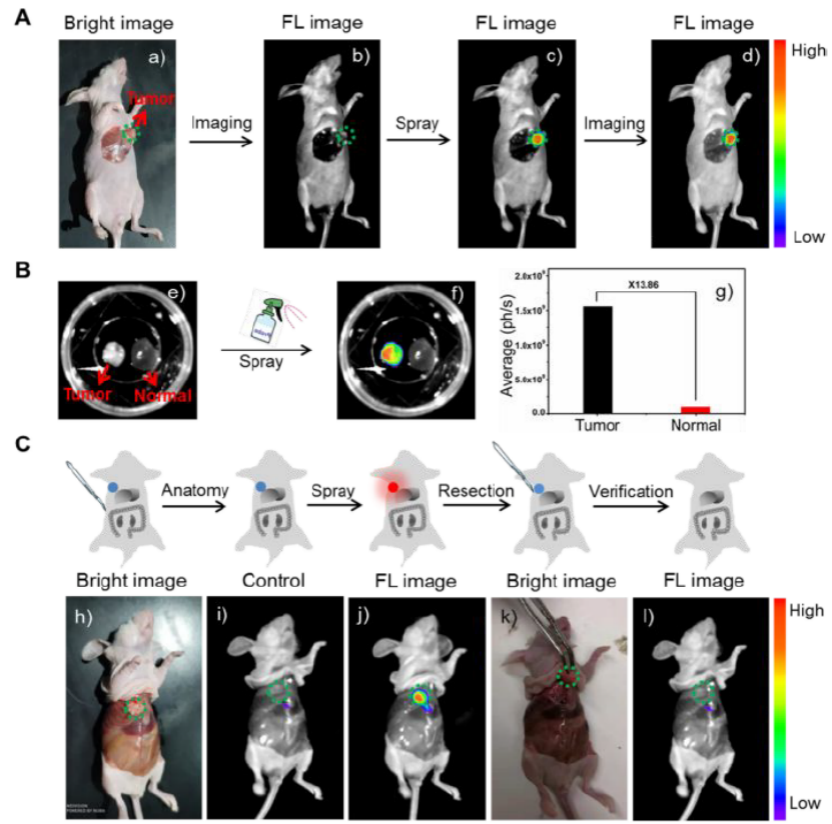
图7. 对具有HepG-2移植瘤的裸鼠喷涂YH-APN,图像指导肿瘤的切除。A)体内原位喷涂成像。a)明场; b)荧光场; c) 喷涂YH-APN后的荧光图; d) 喷涂YH-APN 30 min后的荧光图。B) 体外肝组织和正常肝组织的体外成像(e and f) 喷涂YH-APN30min后,进行荧光成像) 荧光强度统计值。C) 喷涂YH-APN 图像指导切除 h) 明场; i) 荧光场 j) 喷涂YH-APN 30 min后,进而荧光成像; k) 手术移除肿瘤; l) 肿瘤移除后,对其进行荧光成像。
作者分别利用小动物活体成像及体外肝组织成像,来证明喷涂YH-APN,可直接应用于图像指导的肿瘤切除。
(6)转移性癌症成像
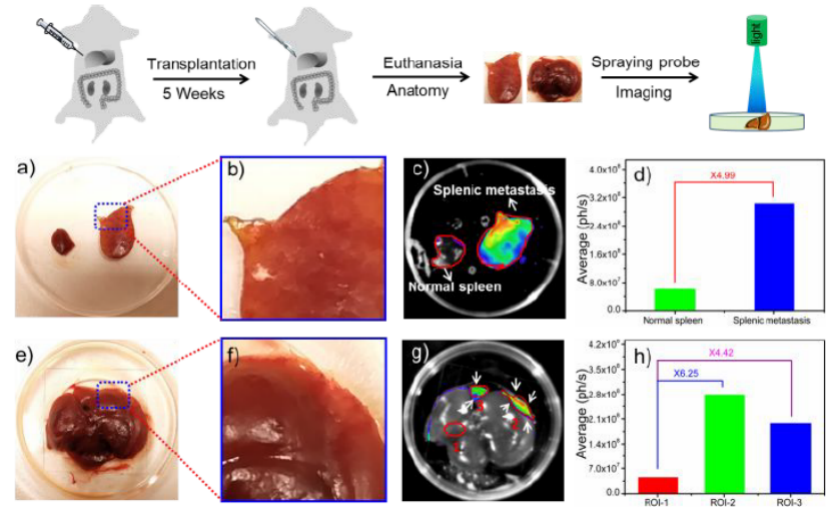
图 8. 通过对长有移植瘤的裸鼠喷涂YH-APN,用于转移性癌症的成像。(近乳腺5周)。 脾脏转移: a)明场(左侧:健康脾脏;右侧:脾脏转移瘤)b) 放大后的细节图; c) 喷涂YH-APN30min后,进行荧光成像; d) 荧光强度统计值。肝转移:e) 明场成像;f) 放大后的细节图; g)喷涂YH-APN30min后,进行荧光成像; h) 荧光强度统计值。
手术切除肿瘤不成功,往往会导致癌细胞的转移。作者将裸鼠处死后,取出其脾脏和肝脏并喷涂YH-APN,可以清晰地看到小于1mm的转移病灶的荧光图像。由此得出其信噪比非常高,可用于转移性癌症的成像表征。
本篇文章引入了一个对癌症特异性标志物APN迅速响应的荧光探针HY-APN,其具有优异的灵敏度及选择性,并可以通过简单喷涂的方式成像转移癌症组织,有望应用于实时引导肿瘤切除手术。
An APN-Activatable Fluorescent Probe for Tracking Metastatic Cancer and Image-Guided Surgery via In-Situ Spraying,Haidong Li, Qichao Yao, Wen Sun, Kun Shao, Yang Lu, Jeewon Chung, Dayeh Kim, Jiangli Fan, Saran Long, Jianjun Du, Yueqing Li, Jingyun Wang, Juyoung Yoon, and Xiaojun Peng J. Am. Chem. Soc., Just Accepted Manuscript • DOI: 10.1021/jacs.0c01365

