ANGEW CHEM丨纳米技术在控制细胞膜表面受体聚集中的新应用
细胞表面受体的空间分布与相互作用在决定细胞命运方面起着重要作用。近年来,使用纳米材料直接调节受体簇的策略引起了研究者们极大的兴趣。2019年,清华大学李景虹院士课题组对这一研究方向做了精辟总结,集中讨论了基于纳米材料的细胞膜受体调控策略的机制和特征,探索了通过控制细胞表面受体的聚集来操纵细胞功能的可能。相关工作以mini review的形式发表于Angewandte Chemie International Edition上。李景虹院士课题组主要从事电化学与纳米电分析化学、生物传感与生物分析化学以及单细胞分析化学等领域的研究。
细胞可以感知细胞外基质(ECM)的纳米尺度特征并产生功能变化。选择性的受体-配体识别是激活细胞功能和决定细胞命运的第一步。在纳米尺度上,细胞表面受体的空间组织在控制细胞信号级联反应中起着关键作用。已知许多细胞行为(例如细胞粘附,扩散,生长和迁移)受细胞表面受体聚集的调节。例如,越来越多的证据表明整联蛋白的激活高度依赖于其纳米级排列,配体纳米级排列中的细微变化可以转化为细胞行为反应。此外,细胞表面受体的聚集可以在病原体感染期间触发某些细胞功能过程。例如,腺病毒在其表面上呈现出细胞粘附肽簇,以同时与多个整合素受体结合,从而导致受体聚集并将病毒传递到细胞中。利用这一机制,Whiteside组证明了多价配体可用作炭疽毒素的抑制剂。在这篇综述中,作者讨论了将受体组织成纳米簇并控制细胞行为的纳米技术的最新发展和应用。本综述旨在强调控制细胞膜受体聚集作为一种调控细胞行为的方法的重要性,并促进在体外和体内实现细胞膜受体聚集可逆控制的创新,以用于机制研究和生物医学应用。
细胞表面受体的空间分布可调节细胞功能
细胞表面受体通过不同的机制将细胞外信号传递至细胞内部。信号转导的重要机制之一是受体聚集。整联蛋白是跨膜细胞表面受体的一大家族,在细胞粘附和细胞骨架形成中起主要作用。整联蛋白通过与精氨酸-甘氨酸-天冬氨酸(RGD)等肽配体结合而介导细胞与细胞外基质之间的通讯。整联蛋白的聚集介导细胞粘附,导致下游信号传导变化和细胞骨架变形。根据Spatz组的研究,RGD的密度阈值相距约70 nm。当RGD配体之间的距离小于70 nm时,细胞将形成粘着斑,并诱导肌动蛋白细胞骨架纤维形成(图1),进一步诱导各种下游途径(例如FAK活化)并决定随后的细胞命运。当RGD配体相距超过70 nm时,细胞将无法很好地附着于细胞外基质,并会通过激活相关的信号通路(例如PI3K和RAC1)寻求迁移。

图1 整合素簇触发的F-肌动蛋白形成和下游信号通路激活的示意图。
另一个重要的细胞表面受体家族是Eph受体家族。Eph受体是受体酪氨酸激酶的一个家族,可与Eph受体介导蛋白(Ephrins)结合被激活。Eph受体在胚胎发育中起关键作用,包括组织边界的形成,细胞迁移和分段。此外,Eph/Ephrin信号传导是血管生成和干细胞分化的关键调节剂,具有高度敏感的寡聚性质。Ephrin结合后,Eph受体通过聚集被激活以形成高度有序的簇,从而触发反式磷酸化诱导信号转导。目前已经开发了几种策略来控制Ephrin的纳米级分布,从而导致更有效的Eph受体簇化和下游信号传导。
受体簇复合物的形成不限于整联蛋白家族或Eph受体。来自不同结构类别的各种细胞表面受体均可以组装成多受体复合物,从而触发许多生物学功能,例如用于免疫识别的T细胞受体(TCR),用于趋化性的30种甲基受体趋化蛋白(MCP)和用于神经元信号传递的mGluR。这些二聚体或寡聚体复合物以惊人的高灵敏度控制细胞反应,这为通过纳米材料与细胞表面受体之间的相互作用控制细胞级联信号转导提供了一种手段。
调控细胞膜受体聚集的策略
(1)分子纳米图案
纳米光刻技术产生的纳米结构表面能够产生高度有序的多价金属表面结合配体与细胞膜受体的相互作用。多年来,高度有序的分子纳米图形已经被用来研究细胞之间的相互作用,基底的纳米尺度特征以及揭示细胞粘附和粘着形成的关键机制和过程。在2007年,M. J. Dalby小组提出了无序纳米模式对于诱导MSC快速成骨的重要性。结果表明,无序纳米结构可以控制MSC成骨,其成骨效率与化学刺激相当。他们的研究结果首次证明,高度有序的纳米图案产生了低到可以忽略不计的细胞粘附和成骨细胞分化。然而,在随机纳米图案上培养的细胞显示出更多的成骨细胞分化。
除了光刻方法外,各种新型纳米材料如自组装聚合物或多肽超结构,为分子纳米图案平台的开发提供了新的机会。例如,Yui研究小组报告了RGD肽修饰的动态聚轮烷(PRX)表面,用于诱导整合素的快速反应。PRX是一种在线性客体分子(聚乙二醇,PEG)上含有可移动宿主分子的超分子(α-环糊精)。经RGD修饰的α-CD可以沿着PEG主链自由移动。使用表面等离子体共振(SPR)表征配体-受体结合,证明附着在高度动态表面上的RGD肽可提高与整联蛋白的接触频率并诱导快速的细胞反应,可用于开发新型生物医学设备,例如高性能细胞分选表面或生物芯片。
与先进的成像技术结合使用时,分子纳米模式平台可用于检查活细胞中细胞表面受体的聚集动力学。在最近的工作中,Martinez小组开发了一种新技术,用于测量活细胞中Eph受体低聚的动力学。该技术可以高敏感地检测Eph-B2受体的低聚状态,并实时定量跟踪Eph-B2受体的低聚过程。结果表明,随机分布的表面结合配体不足以完全诱导受体聚集。然而,纳米图案的配体可以有效地诱导强烈的受体寡聚化(图2)。
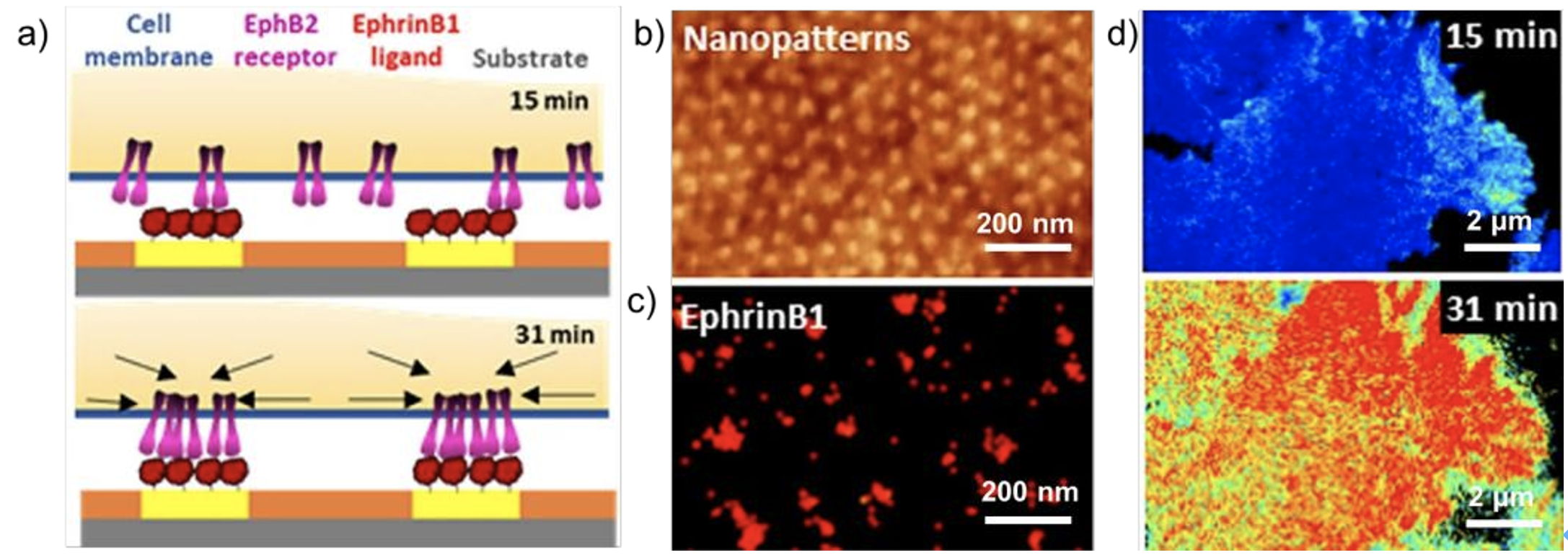
图2 a)用于调节Eph-B2受体簇的Ephrin-B1纳米模式图。b)AFM图像显示了使用自组装共聚物形成的规则尺寸的EphrinB1纳米图案。聚甲基丙烯酸甲酯域的主直径为29±2 nm,粒子间距为64±5 nm。c)与抗Fc荧光抗体结合后,Ephrin-B1/Fc功能化的纳米图案的dSTORM荧光图像。纳米团簇的平均直径为27±19 nm。d)数字和亮度技术的统计增强版本可以区分扩散物种的低聚状态,用于实时定量跟踪Eph-B2受体的低聚过程。结果表明,纳米图案的配体可以有效地诱导强烈的受体寡聚。
(2)磁场驱动的纳米粒子
磁场可以对磁性纳米粒子施加强大的力,并触发粒子聚集。考虑到磁场在生物学上是惰性的,纳米粒子的磁驱动可以成为控制细胞表面受体聚集并将磁输入转换为生理细胞输出的强大工具,并具有快速响应和无创动态控制的功能。最近,Schneck研究小组使用纳米级人工抗原呈递细胞(nano-aAPC)来诱导抗原特异性T细胞活化。结果证明,施加外部磁场可以诱导nano-aAPC在T细胞表面形成纳米团簇,并增强T细胞的活化和增殖。nano-aAPC在磁场中激活的T细胞可在小鼠模型中抑制B16黑色素瘤的生长,显示了过继免疫疗法的潜在临床应用。这些工作表明,磁性致动器可以用于以非侵入性和磁性方式控制细胞表面受体的聚集。由于磁性纳米颗粒可以通过精确的时空控制将磁性输入转化为生物信号,因此它们是控制体内细胞功能(如诱导免疫反应)的潜在有价值的工具。
(3)聚合物
刺激响应性聚合物在遇到各种刺激后,其大小可能会发生变化。能够响应外部刺激的聚合物对于构建响应性纳米材料以控制细胞表面受体的聚集非常有意义。将响应性聚合物与生物大分子结合,合成的智能杂化材料已发展成为生物系统中的重要组成部分。Hoffman小组首先将温度敏感的聚合物聚(N-异丙基丙烯酰胺)(聚(NIPAAm))与链霉亲和素分子结合,以控制生物素-链霉亲和素的相互作用。这种对温度敏感的聚合物可以通过嵌入链霉亲和素分子来可逆地控制结合过程。当温度高于32℃时,聚合物将塌陷以嵌入链霉亲和素分子,从而阻止生物素与链霉亲和素的相互作用。
利用环境因素控制配体与受体的结合过程在生物技术和生物医学领域也有相关研究。例如,为了控制受体在细胞表面的聚集,Salaita研究小组开发了光机械致动器(OMA)纳米粒子,该纳米粒子在细胞表面的受体张力作用下会透射近红外光。OMA纳米粒子由涂有热响应性聚合物的金纳米棒(25×100 nm)组成(图3a)。金纳米棒起着光热传感器的作用,并将近红外光转换为局部热量,从而驱动聚合物收缩(图 3b)。使用该OMA,可以控制整合素为基础的局灶性粘连形成,细胞突起和迁移(图3c,3d,3e),和T细胞受体激活。

图3 用于控制活细胞机械转导的纳米级光机械致动器(OMA)。a)纳米级光机械致动器的机理。OMA纳米粒子在照射后迅速收缩,从而对装饰固定颗粒的受体-配体复合物施加机械力。b)在去离子水中不同温度下的OMA纳米粒子的原子力显微镜(AFM)图像。c)OMA纳米颗粒对细胞迁移和T细胞活化的光学控制,响应OMA刺激的NIH/3T3细胞迁移的延时图像。白色虚线圆圈表示NIR照明的区域。d)在(c)中的白色虚线箭头方向上测量的细胞迁移的运动记录仪分析。e)OMA刺激后,细胞迁移距离与时间的关系。
(4)DNA纳米结构
由于DNA具有通过序列定向杂交形成可编程结构的能力,它已成为纳米结构制造的强大材料。功能性的DNA纳米结构,例如DNA折纸,DNA适体,和DNAzyme,可以作为构建纳米结构的基石,以控制细胞表面受体的聚集。
近年来,DNA适体结构被用来将非相关信号传递给细胞应答信号。例如,Sando小组开发了一种非遗传方法来重新编程受体酪氨酸激酶(RTKs)的配体特异性(图4)。RTK是调节基本细胞活动(例如细胞增殖,迁移和分化)的细胞表面受体。重新编程RTKs的配体特异性提供了一个机会,可以以用户定义的方式自定义细胞信号传导并通过外部刺激指导细胞行为。使用一种双特异性DNA适体,该适体由与RTK结合的适体序列和与外部信号(血小板衍生的生长因子(PDGF))结合的另一种适体序列组成,发现可以通过添加外部信号诱导RTK二聚化和激活。该概念可以与现有的基于DNA的逻辑电路或基于蛋白质的分子设备进一步集成,以开发智能安全的再生药物,这些药物可以在应用用户定义的外部信号后诱导细胞活性。

图4 双特异性DNA适体,用于重编程受体-配体相互作用。a)由生长因子结合诱导的酪氨酸受体激酶(RTKs)的激活机制。b)DNA适配体介导的受体酪氨酸激酶(DRIPaR)相互作用重编程的工作机制。
此外,DNA折纸技术也被用来精确调控配体功能(图5a),Teixeira研究小组开发了一种合理设计的DNA折纸纳米结构,该结构在确定的位置上修饰配体,称为纳米卡尺(NC,图5)。使用DNA的NC呈递Ephrin配体,可以精确调节Ephrin-A5的纳米尺度间距,以指导人类乳腺癌细胞中EphA2受体的激活水平(图5b),并进一步调节这些细胞的侵袭特性(图5c)。

图5 DNA纳米卡尺(NC)用于细胞表面受体功能的空间控制。a)通过稍微改变用于组装DNA折纸NC的DNA寡核苷酸序列,可以将蛋白质配体放置在不同的位置。b)Ephrin-A5配体的空间分布决定了Eph-A2受体的磷酸化水平。c)用NC-empty,NC100或NC40处理后的乳腺癌细胞MDA-MB-231的相对侵袭性。
细胞表面受体聚集引发的下游细胞功能调控
细胞间的通讯过程和信号转导的启动往往依赖于细胞表面多个受体-配体复合物的形成。通过控制细胞膜上受体的空间组织,可以以用户定义的方式精确调节受体活性和细胞结果。由于纳米尺度的特性,合成的多价纳米材料是控制复杂细胞-配体结合事件的有效工具。多价配体可作为诱导受体介导的信号转导通路的抑制剂或激活剂。此外,这些策略可以使人们深入了解细胞是如何感知多价结构和反应的。
(1)控制干细胞分化
神经干细胞(NSC)是重要的具有治疗意义的细胞,具有在整个生命中产生新神经元和神经胶质的能力。Stupp研究小组报道了一种DNA纳米管,它与细胞粘附肽RGD共价功能化,作为NSC分化的生物活性底物。研究发现,使用共组装的生物活性DNA/肽纳米结构可以促进细胞黏附并随后将NSCs分化为神经元,但不能分化为星形胶质细胞。另一个重要的干细胞类别是人多能干细胞(hPSC)。hPSC包括人类胚胎干细胞(hESCs)和诱导多能干细胞(hiPSC),它们具有分化为成体的所有细胞的能力,因此为细胞替代疗法和人类疾病模型提供了广阔的潜力。为了调节用于治疗应用的hPSC中的Ephrin-Eph受体信号通路,Schaffer小组设计了一种合成的多价配体,使用高分子量透明质酸(HA)来调控Ephrin-B2(图6)。这项研究表明,多价配体可以显著增强调节干细胞行为的配体的生物活性。通过研究受体聚集的机械作用,研究人员发现细胞-细胞-接触依赖性Delta-Notch,c-kit,Fas配体和Flt配体信号传导以及基质结合成纤维细胞生长因子(FGF),转化生长因子-β(TGF-β),刺突(Hh),血管内皮生长因子(VEGF)信号传导和其他信号传导系统可以通过纳米级合成配体进行调控,这些配体可以仿生方式激活受体。

图6 多价Ephrin-B2可增强神经干细胞(NSC)的分化。a)举例说明蛋白质(绿色)与800 kDa线性透明质酸(HA;蓝色)的结合,以及随后添加到细胞中的受体(红色)的聚集,诱导神经元分化。b)培养的NSC在单独的培养基中或在未聚结的Ephrin-B2,抗体聚成的Fc-ephrin-B2或多价1:22 HA:Ephrin-B2的情况下分化了6天,然后对其进行了免疫染色神经元标记物βIII-微管蛋白和细胞核。c)分化6天后,对神经元转录物Tubb3进行qPCR测试。
最近,对生物活性配体的远程和非侵入性控制已应用于干细胞分化的调控。Bian小组开发了一种异质二聚体纳米开关,该纳米二聚体由磁性纳米笼与RGD涂层金纳米颗粒组成,以调节干细胞的黏着性,扩散和分化,从而有可能增强再生疗法的效果。Qu小组开发了一种基于光控上转换的底物,以指导使用近红外光的MSC分化。
(2)T细胞激活
T细胞通过测量其TCR与负载肽的主要组织相容性复合物(pMHCs)的结合强度来控制免疫反应。由于T细胞活化对于免疫应答的启动和调节至关重要,控制T细胞活化以调节免疫应答在免疫治疗领域引起了人们的兴趣。纳米技术已被用于研究T细胞功能。例如,基于DNA的合成T细胞信号系统已被用于揭示受体簇在T细胞配体识别中的作用。研究人员使用不同密度的基于DNA的配体,发现T细胞信号传导可以区分具有单个碱基对的DNA配体,而更高亲和力的配体则促进了TCR的聚集和磷酸化。
根据以前的报道,通过将pMHC呈递给相关的TCR,纳米级人工抗原呈递材料应能够诱导抗原特异性T细胞活化。最近,Rhodes等人撰写了一篇综述,概述了纳米aAPC在癌症免疫治疗中的使用。已经证明,T细胞活化蛋白功能化的磁性纳米粒子的聚集可以驱动大量活化的抗原特异性细胞的生成并抑制B16黑色素瘤的生长。
(3)细胞附着,迁移和凋亡的调控
通过控制细胞表面受体,可以调节特定的细胞信号通路,从而进一步影响下游细胞行为,例如细胞附着,增殖,迁移和凋亡。Kiessling研究小组的开创性工作已经证明,携带L-选择素结合碳水化合物的聚合物可以促进L-选择素聚集和随后的白细胞脱落。Zhao研究小组开发了一种多价配体,该多价配体由装饰有抗体的聚合DNA支架组成,可调节细胞受体的信号传导和功能。以CD20簇介导的B细胞癌细胞凋亡为模型系统,他们证明了基于DNA的多价配体在诱导靶细胞凋亡方面明显比单价配体更有效。
为了可逆地控制细胞表面受体的聚集,李景虹院士小组设计了一种DNA纳米弹簧多价配体方法来调节细胞结合配体的纳米级分布并控制细胞行为(图7)。他们制备了长DNA序列编码的多个发夹结构,可以通过DNA链置换反应执行类似弹簧的运动。通过细胞结合基序(RGD)修饰,多价DNA纳米弹簧能够可逆地控制细胞表面受体的聚集,这可能进一步影响HeLa细胞中mRNA的产生并诱导细胞突起的发展。

图7 DNA纳米弹簧可逆地控制细胞表面受体功能。a)可逆控制整联蛋白簇的DNA纳米弹簧图。b)通过滚环扩增产生的长DNA序列被用作支架,以设计形式组装RGD氨基酸序列。添加外部DNA序列(cDNA1和cDNA2),通过链置换反应可逆地改变RGD序列之间的距离。c)DNA纳米弹簧触发的整联蛋白聚集和去聚集能够调节细胞内信号通路和细胞形态。
总结与展望
控制细胞表面受体聚集的能力为科学家提供了研究细胞功能,研究分子信号传导途径和操纵细胞行为的强大工具。在这篇综述中,作者重点介绍了使用纳米技术控制细胞表面受体聚集的几种最新策略。这些示例根据所使用的材料大致分为分子纳米图案,纳米颗粒的磁性驱动,生物聚合物和DNA纳米材料。这些策略的应用概括为控制干细胞分化,T细胞活化以及调节细胞附着,迁移和凋亡,突出了控制细胞表面受体簇对影响小鼠生理过程的重要性。
由于细胞表面受体聚集是受体间距的纳米尺度变化,因此纳米材料在精确操纵受体的空间结构以确定细胞命运方面具有巨大的应用前景,并为细胞生物学提供了一个强有力的工具。利用多用途的表面修饰和独特的光学/磁性特性,可控的纳米结构可进一步用于构建刺激响应系统。
但是,现有方法仍主要基于静态材料,并且可调节和可逆地控制细胞表面受体簇的工具仍然非常有限。由于需要在体内进行非侵入性应用,因此迫切需要开发用于远程和可逆地控制体内细胞表面受体簇集的纳米材料,这可能会带来研究生理和病理细胞过程的新方法,例如干细胞分化,T细胞活化,病原体感染和癌症发展。此外,可移动的纳米结构材料在组织工程,再生疗法,免疫疗法和许多其他生物医学应用中动态指导细胞表面受体的聚集具有巨大潜力。
Kaixiang Zhang, Hua Gao, Ruijie Deng, Jinghong Li*. Emerging Application of Nanotechnology for Controlling Cell Surface Receptors Clustering. Angew. Int. Chem. Ed., 2019, 58(15):4790-4799.

