NUCLEIC ACIDS RES丨基于纳米二次离子质谱(Nano-SIMS)可视化及定量分析细胞及组织中的核酸类药物
作者:李好问
核酸类药物(NATs)在促进特定转录文本的降解、修饰基因表达以及调节mRNA剪接等方面已经被证明是有独特的效用。而在各种情况下,核酸向细胞、组织以及细胞内的有效递送都是至关重要的。为此,优化药物效率减少毒副作用极为重要。尽管NATs已经取得成功,但是对于其在组织及细胞中的吸收以及分布的了解依然有限。通过放射性标记的核酸研究,如硫代磷酸酯的反义寡核苷酸(ASO)特异性抗体的免疫组化研究获得了ASO的药代动力学研究,但是却无法同时获得不同细胞类型和亚细胞器中的分布。利用荧光标记物偶联的ASO和siRNA的荧光显微镜研究使得可视化ASO成为可能,但荧光的修饰对药物递送的影响以及共聚焦显微镜的分辨率和灵敏度的限制其在细胞及亚细胞结构中的分布研究。至此,如何尽可能原位的精准监测NATs在细胞以及组织中的摄取及分布?
近日,加州大学洛杉矶分校的Punit P. Seth课题组、西澳大学的蒋海波教授等人在国际核酸研究顶刊-《核酸研究》(Nucleic Acid Res.)上发表研究论文《High-resolution visualization and quantification of nucleic acid-based therapeutics in cells and tissues using Nanoscale secondary ion mass spectrometry (Nano-SIMS)》,报道了利用纳米二次离子质谱可视化及定量分析细胞及组织中的核酸类药物。
Nano-SIMS使用聚焦133Cs+离子束作为一次离子束轰击细胞或者组织切片溅射出数百万个带负电的二次离子(例如 1H–,12C14N–,16O–,32S–,79Br-),通过质谱分析确定大小并定量,利用获得的数据可以仅基于单个同位素或者不同同位素的比率获得细胞和组织的成像,其最高横向分辨率是40 nm,远高于共聚焦显微镜的分辨率,但是低于透射电子显微镜或扫描电子显微镜的背散射电子(BSE)成像分辨率。
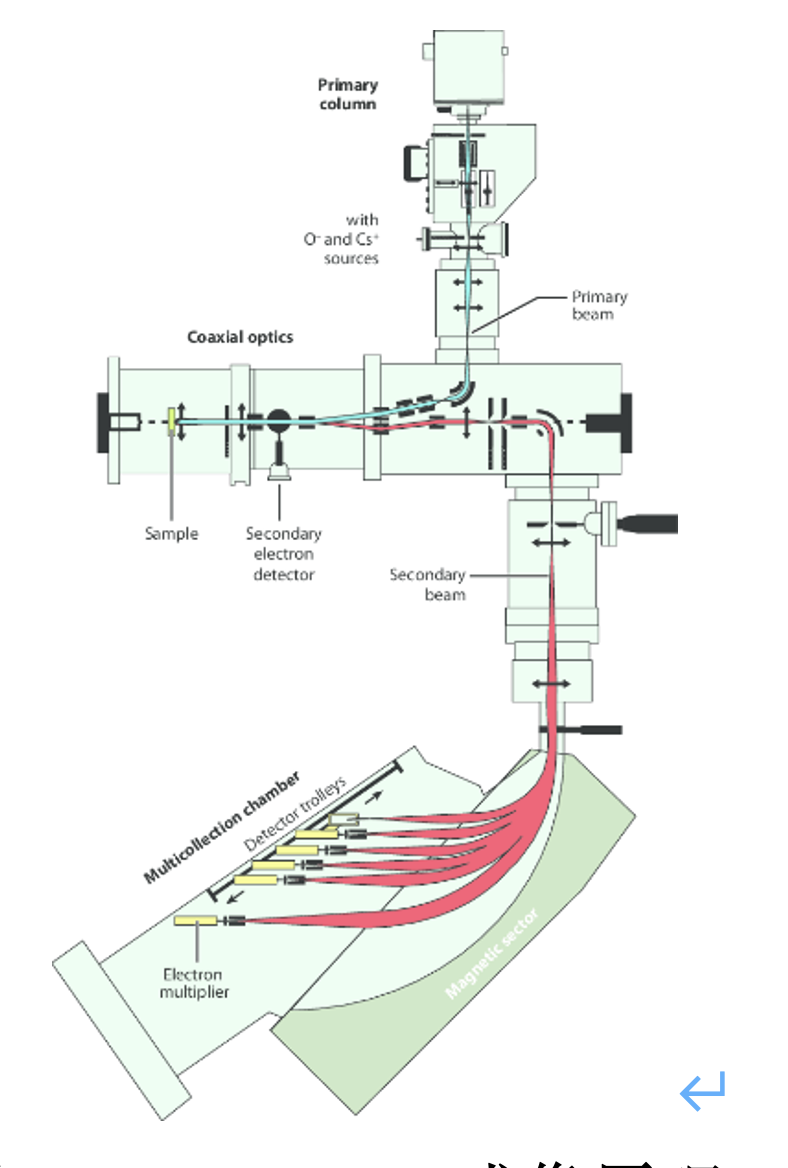
图1. Nano-SIMS成像原理。
研究人员利用Nano-SIMS实现了5-溴脱氧尿嘧啶核苷(5-BrdU)修饰的ASO在细胞以及组织中的高灵敏以高空间分辨的成像分析。该方法监测了ASO在不同亚细胞结构中的摄取和分布,并量化靶向配体促进细胞对ASO的摄取。研究发现,硫代磷酸酯的ASO摄取与细胞中的丝状伪足和内核膜有关,并且还揭示了小鼠组织中摄取ASO的大量细胞和亚细胞异质性。Nano-SIMS成像显示了NATs的可视化摄取及分布的重要进展,有利于优化NATs的效用和递送用于治疗人类疾病。
首先,研究人员合成了标有Br以及34S的malat1特异性的ASO(图1 A-B)。Br-ASO包含79Br和81Br。在34S-ASO中,将34S(自然丰度,4.5%)并入了主链中,34S-ASO不会改变ASO的特性。选择Br标记策略,因为含有Br修饰的尿苷的寡核苷酸具有与未修饰的寡核苷酸具有相似的活性。发现34S-ASO和Br-ASO(图1)减少细胞中Malat1表达的活性类似于未修饰的ASO的活性,IC50范围为12~18 nM(图1C-D)。

图2. 用于Nano-SIMS成像的ASOs。
在无转染试剂(自由摄取)的情况下,将HeLa细胞分别在含有34S-ASO或Br-ASO(5μM)的培养基中孵育24 h,然后将细胞固定后用于Nano-SIMS成像。如图3所示,34S/32S以及79Br的SIMS成像显示了34S-ASO和Br-ASO在细胞器中的累积。如图2-B所示,Nano-SIMS清晰地检测到Br-ASO在HeLa细胞核中的分布。由于Br在细胞中的背景极低,相比于34S/32S,79Br的图像更加清晰优于34S,因此接下来的工作重点放在Br-ASO在细胞及组织的成像上。
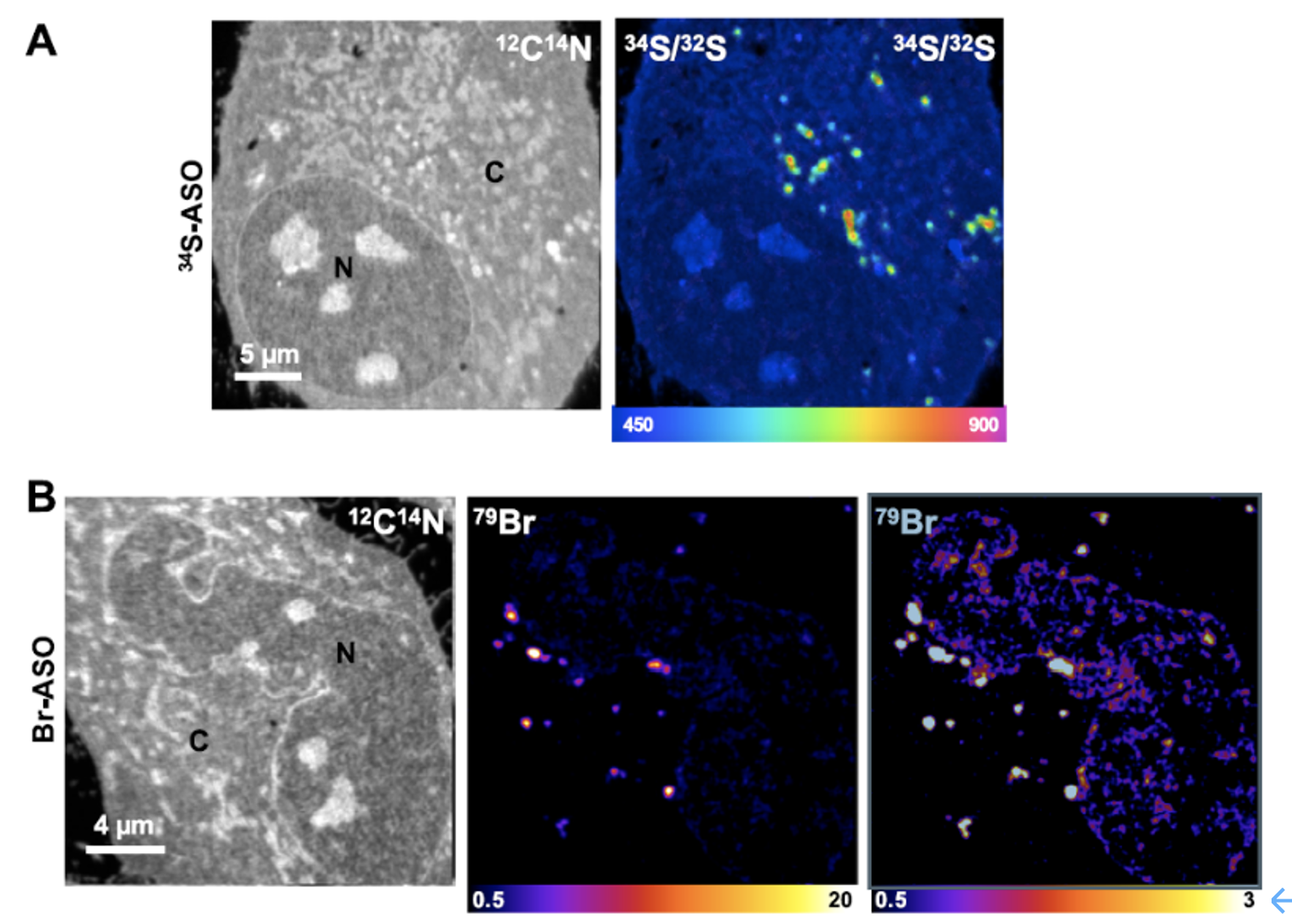
图3. 34S-ASO和Br-ASO在HeLa细胞中的Nano-SIMS成像。
将已在含有Br-ASO的培养基中培养的HeLa细胞(自由摄取)或Br-ASO脂质体转染的HeLa细胞经过BSE成像和Nano-SIMS成像分析。BSE成像获得500 nm厚的HeLa细胞切片的超微结构特征,然后由Nano-SIMS分析。这种组合的成像方法使我们能够将Nano-SIMS化学成像的信息与BSE成像提供的超微结构细节相关联。含Br-ASO的培养基中孵育的HeLa细胞中,在内体、内核膜、核质和核仁中都容易检测到Br-ASO,如图4所示。

图4. BSE和Nano-SIMS成像HeLa细胞自由摄取Br-ASO的成像分析。(白色标尺4 μm)
接下来,研究者合成了与N-乙酰半乳糖胺(GalNAc)偶联的Br-ASO,GalNAc是去唾液酸糖蛋白受体(ASGR)的配体。在肝脏中,ASO结合半乳糖胺已经显示出增加ASO活性20-30倍。研究者发现,与未加GalNAc偶联的ASO的活性相比,结合GalNAc的ASO的活性在培养的表达ASGR1的HEK 293细胞(1A4细胞)中减少Malat1表达超过 60倍。GalNAc-Br-ASO的Br标记不会改变活性,GalNAc-Br-ASO的IC50为30 nM,GalNAc-ASO的IC50为33 nM。将野生型HEK 293细胞或1A4细胞在含有Br-ASO或GalNAc-Br-ASO的培养基中孵育,然后进行BSE和Nano-SIMS成像处理。在1A4细胞中,GalNAc-Br-ASO的摄取远大于Br-ASO的摄取。但偶联GalNAc后,对野生型HEK 293细胞中ASO的摄取没有影响(图5A)。在1A4细胞中,发现在所有亚细胞结构,包括内体、线粒体、内质网、高尔基体,核质和核仁,GalNAc结合的ASO的含量均增加(图5B)。

图5. ASGR阳性或者阴性的HEK 293细胞对于GalNAc偶联的ASO的摄取的影响。(白色标尺为4 μm)
向野生型小鼠皮下注射Br-ASO(32 mg / kg)。72小时后,收获肝脏、肾脏和心脏进行处理,以进行相关的BSE和Nano-SIMS成像。在BSE图像中鉴定出亚细胞器(线粒体、溶酶体、高尔基体,内质网和细胞核),并通过Nano-SIMS分析了这些结构中Br-ASO的分布(图6)。在初步研究中,能够检测到肝细胞之间的肝细胞、肾小管细胞和孤立细胞之间的溶酶体中巨噬细胞的Br-ASO。

图6. BSE成像组织的结构分布以及Nano-SIMS成像Br-ASO在组织中的分布。(白色标尺为4 μm)
为了进一步探索Br-ASO的分布,由Nano-SIMS成像了肝脏,心脏和肾脏的大区域(图7-9)。我们观察到肝细胞,库普弗细胞和正弦毛细血管内皮细胞中Br-ASO的摄取,库普弗细胞的摄取水平最高(图7 A-C)。与肝细胞相比,库普弗细胞和毛细血管内皮细胞中的Br信号分别高5.6倍和2.2倍(图7 C)。我们观察到了在不同肝细胞中Br-ASO积累的实质异质性(图7 D),即使在紧邻的肝细胞(图7 B中area-B和area-C)。在用Br-ASO处理过的小鼠的某些肝细胞中,Br的富集程度仅略高于本底,但是在其他肝细胞中,Br的富集度比未经处理的小鼠高约6.5倍(图7 D)。Br-ASO可以在大多数肝细胞的溶酶体中观察到(图7)。肝细胞内溶酶体中的Br信号比其余细胞质高约20倍,比肝细胞核高约26倍(图7 E))。我们观察到Br-ASO在库普弗细胞的细胞核和细胞质中溶酶体中出现累积(图7 B-areaA;图7 E)。库普弗细胞的细胞核、细胞质和溶酶体中的Br富集程度分别比肝细胞分别高4.9倍,2.4倍和3.2倍(图7 E)。在沿肝脏正弦曲线排列的毛细血管内皮细胞内的离散细胞质中也观察到了Br-ASO(图7 B-areaA和areaB)。

图7. BSE成像肝脏的结构分布以及Nano-SIMS成像Br-ASO在肝脏中的分布。(白色标尺为4 μm)
Nano-SIMS对心脏的大区域成像(图8)显示出心肌细胞之间大多数的巨噬细胞中出现Br累积,但心肌细胞中的Br富集水平可忽略不计。相反,心脏巨噬细胞中的Br富集度很高(图8),其中溶酶体中的Br富集水平比对照小鼠高约33倍。
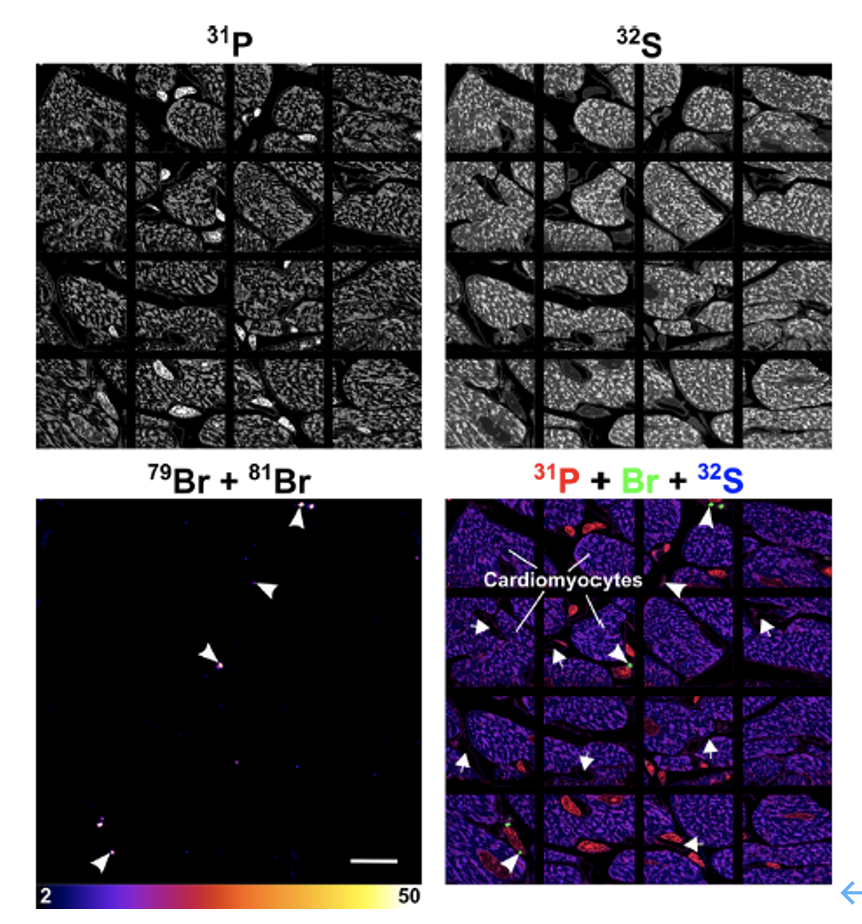
图8. Nano-SIMS成像Br-ASO在心脏中的分布。(白色标尺为20 μm)
然后成像了更大区域的肾脏(图9)。在肾小管细胞的溶酶体中观察到Br-ASO的积累。经Br-ASO处理的小鼠肾小管细胞内溶酶中的Br富集度比基膜高约70倍,比未经对照的小鼠肾小管细胞内溶酶中的Br富集高178倍。仅注射生理盐水的小鼠组织中的Br富集水平极低。
在自由摄取研究中,观察到Br-ASO沿HeLa细胞的内核膜积累,从而增加了沿内核膜的结合位点影响ASO转运和分布的可能性。没有观察到在脂质转染的细胞中Br-ASO沿内膜积累,在ASO导入细胞核中会有所不同。还没有观察到HEK293细胞中Br-ASO的内核膜积聚。已知ASO在肾脏中的浓度很高,因此,对在Br-ASO处理的小鼠肾脏中发现溴富集并不感到惊讶。但是,Nano-SIMS图像再次提供了更完善的见解。首先,发现几乎所有的Br-ASO都位于肾小管上皮细胞中-几乎所有的Br-ASO都位于溶酶体中。肾脏中溶酶体的溴富集程度分别比肝脏和心脏高约6.5倍和约6.2倍。在肾小管细胞的溶酶体外部,肾小管细胞中的溴富集微不足道,通常不大于注射了生理盐水的对照小鼠的肾小管细胞中的溴富集。Br-ASO处理过的小鼠肾小球中的溴富集量极低。

图9. Nano-SIMS成像Br-ASO在肾脏中的分布。(白色标尺为20 μm)
在注射了Br-ASO的小鼠中,心肌细胞中的Br富集与生理盐水的对照小鼠的基本一致。然而,有趣的是,我们观察到分散在心肌细胞中的巨噬细胞中Br的富集。心脏巨噬细胞(以及细胞的溶酶体)中的Br富集水平与肝细胞中的富集水平相当。例如,可以想象ASO治疗剂可用于治疗心脏异体移植的排斥反应这一过程中,巨噬细胞被认为是组织损伤的效应器。
这种方法可以定义ASO在不同亚细胞区室的摄取和分布,并量化旨在促进细胞摄取ASO的靶向配体的影响。研究表明,硫代磷酸酯ASO与细胞中的丝状伪足和内核膜有关,并且还揭示了小鼠组织中ASO摄取的大量细胞和亚细胞异质性。Nano-SIMS成像代表了可视化NATs摄取和分布方面的重大进步。
Cuiwen He, Michael T. Migawa, Kai Chen, Thomas A. Weston, Michael Tanowitz, Wenxin Song, Paul Guagliardo, K. Swaminathan lyer, C. Frank Bennett, Loren G. Fong, Punit P. Seth, Stephen G. Young and Haibo Jiang. High-resolution visualization and quantification of nucleic acid-based therapeutics in cells and tissues using Nanoscale secondary ion mass spectrometry (NanoSIMS). Nucleic Acids Research, DOI: 10.1093/nar/gkaa1112。

